题目内容
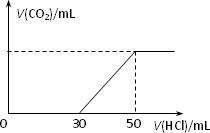
标况下,在100 mL 0.1 mol·L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示.

(假设生成的CO2全部逸出).
求:(1)该稀盐酸物质的量浓度c(HCl).
(2)滴加稀盐酸至50mL时共产生气体体积.
(3)滴加盐酸前溶液中所含溶质的成分及各自的物质的量浓度.
答案:
解析:
解析:
|
(1)加入HCl 50 mL时,溶液中刚好全生成NaCl c(HCl)=0.1 L×0.1 mol·L-1/0.05 L=0.2 mol·L-1 (2)加入HCl 30 mL后,发生的反应为NaHCO3+HCl 所以V(CO2)=0.02 L×0.2 mol/L×22.4 L/mol=0.0896 L (3)从图像可知,第一阶段(无气体产生)耗去30 mL盐酸大于第二阶段(产生气体并达最大量)耗去的20 mL盐酸的体积,可知溶液中溶质的成分只能是NaOH、Na2CO3 c(NaOH)=0.02 mol·L-1 c(Na2CO3)=0.04 mol·L-1
|

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目


 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率
(填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率
(填“增大”、 “减小”或“不变”)。