题目内容
19.1999年曾报道合成和分离了含高能量的N5+的化合物N5AsF6,下列叙述错误的是( )| A. | N5+中氮-氮之间是以共价键结合 | B. | N5+具有35个电子 | ||
| C. | 化合物N5AsF6中As的化合价为+5 | D. | 化合物N5AsF6中F的化合价为-1 |
分析 A.非金属元素之间易形成共价键;
B.阳离子电子数=质子数-电荷数;
C.N5AsF6中阳离子是N5+,则阴离子是AsF6-,AsF6-中F元素显-1价;
D.氟元素是最活泼的非金属元素,F原子最外层有7个电子,容易得1个电子变成8电子稳定结构.
解答 解:A.非金属元素之间易形成共价键,N5+中氮-氮之间是以共价键结合,故A正确;
B.阳离子电子数=质子数-电荷数=5×7-1=34,故B错误;
C.N5AsF6中阳离子是N5+,则阴离子是AsF6-,AsF6-中F元素显-1价,所以As元素显+5价,故C正确;
D.氟元素是最活泼的非金属元素,F原子最外层有7个电子,容易得1个电子变成8电子稳定结构,所以该化合物中F元素为-1价,故D正确;
故选B.
点评 本题考查化学键、电子数的计算、化合价判断等知识点,侧重考查学生分析计算能力,明确化学键概念、电子数的计算方法及化合价判断方法即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.C1O2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得C1O2:
2KClO3+H2C2O4+H2SO4$\frac{\underline{\;加热\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是( )
2KClO3+H2C2O4+H2SO4$\frac{\underline{\;加热\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是( )
| A. | KClO3在反应中是氧化剂 | |
| B. | 1mol KClO3参加反应,在标准状况下能得到22.4L气体 | |
| C. | 在反应中H2C2O4既不是氧化剂也不是还原剂 | |
| D. | 1mol KClO3参加反应有1mol电子转移 |
14.某化学兴趣小组为提取海带中的碘,设计如图所示的流程,下列有关说法正确的是( )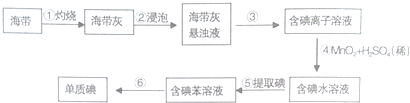

| A. | 步骤①④⑤均属于化学变化 | |
| B. | 步骤④中MnO2的作用是催化剂 | |
| C. | 步骤⑤所用主要仪器是分液漏斗、烧杯 | |
| D. | 步骤⑥操作名称是萃取、分液 |
11.有机化合物A的分子式为C5H12O,且能与金属钠反应放出氢气,那么A的同分异构体的数目(包括A)为( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
8.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)B基态原子中能量最高的电子所处的能级为2p其电子云在空间有3个方向,原子轨道呈纺锤形;
(2)某同学根据上述信息,推断C基态原子的核外电子排布为,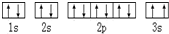 ,该同学所画的电子排布图违背了泡利不相容原理
,该同学所画的电子排布图违背了泡利不相容原理
(3)G位于ⅦB族d区,价电子排布式为3d54s2
(4)DE3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其空间构型为三角锥形
(5)1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键.
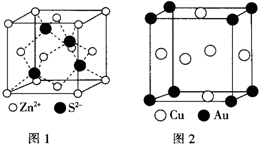
(6)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为4.
(7)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为$\frac{389}{{N}_{A}×{a}^{3}×1{0}^{-21}}$(用含“a、NA 的代数式表示)g•cm-3.

| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 G在周期表的第七列 |
(2)某同学根据上述信息,推断C基态原子的核外电子排布为,
 ,该同学所画的电子排布图违背了泡利不相容原理
,该同学所画的电子排布图违背了泡利不相容原理(3)G位于ⅦB族d区,价电子排布式为3d54s2
(4)DE3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其空间构型为三角锥形
(5)1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键.
(6)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为4.
(7)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为$\frac{389}{{N}_{A}×{a}^{3}×1{0}^{-21}}$(用含“a、NA 的代数式表示)g•cm-3.
9.为提纯下列物质(括号内的物质是杂质),所选用的除杂实际和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | SO2(乙炔) | 溴水 | 洗气 |
| B | 苯(溴) | KI溶液 | 分液 |
| C | 乙醇(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | 乙烷(乙烯) | KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
 ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
 CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是 .
.