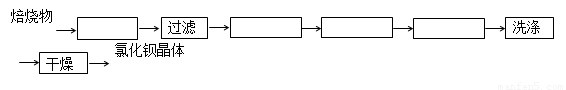题目内容
工业上从重晶石矿(![]() )提取钡盐.如制硫化钡时,用重晶石(含
)提取钡盐.如制硫化钡时,用重晶石(含![]() >85%)和煤(含C>75%)按100∶25~27(质量)比混合,放入转炉中于1000℃~1300℃反应生成BaS,另一生成物为CO,转炉尾气中含
>85%)和煤(含C>75%)按100∶25~27(质量)比混合,放入转炉中于1000℃~1300℃反应生成BaS,另一生成物为CO,转炉尾气中含![]() 可达20%~25%,几乎不含CO.反应后产物为粗硫化钡(可溶钡>65%),经热水(85℃)溶成含BaS~220g/L,过滤,蒸发,冷却得BaS·6
可达20%~25%,几乎不含CO.反应后产物为粗硫化钡(可溶钡>65%),经热水(85℃)溶成含BaS~220g/L,过滤,蒸发,冷却得BaS·6![]() 晶体.写出反应的化学方程式.
晶体.写出反应的化学方程式.
(1)重晶石与煤共热:________________________________________.
(2)尾气中“不含”CO的原因:______________________________.
答案:
解析:
解析:
|
解析:本题是根据煤中的C和反应产生的CO在高温下有还原性,可把 |

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。