题目内容
【题目】下列各图是实验室制取和收集气体的常用装置:
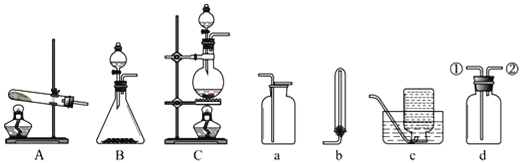
(1)用A装置制取氨气的化学方程式是___________________________________。若用B装置制取氨气,则选用的药品是________________________________。
(2)收集干燥氨气时,选用的干燥剂是___________________________________。
(3)图a、b、c、d是某学生设计的收集气体的几种装置.若用d装置收集氨气,则气体流向为___________(用序号说明).若要收集NO气体,则应选择______装置;
(4)若用C装置与d装置相连制取并收集X气体,则X可能是下列气体中的_____。
①CO2 ②NO ③Cl2 ④SO2 ⑤NH3
(5)按图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是_______________________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是___________________________________________。
 。
。
【答案】2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O; 浓氨水与碱石灰(或生石灰或NaOH固体) 碱石灰(或生石灰) ②进①出 c ③④ 产生白烟 烧杯中的石蕊溶液会倒流进入到B瓶中,形成红色溶液
CaCl2+2NH3↑+2H2O; 浓氨水与碱石灰(或生石灰或NaOH固体) 碱石灰(或生石灰) ②进①出 c ③④ 产生白烟 烧杯中的石蕊溶液会倒流进入到B瓶中,形成红色溶液
【解析】
(1)实验室用氯化铵和氢氧化钙在加热条件下制备氨气,方程式为:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;若用B装置制取氨气,利用了氨气易挥发的性质,一般可用浓氨水与生石灰(或NaOH固体),生石灰、氢氧化钠吸水,并放出大量的热,有利于氨气的生成;综上所述,本题答案是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;若用B装置制取氨气,利用了氨气易挥发的性质,一般可用浓氨水与生石灰(或NaOH固体),生石灰、氢氧化钠吸水,并放出大量的热,有利于氨气的生成;综上所述,本题答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O,浓氨水与碱石灰(或生石灰或NaOH固体)。
CaCl2+2NH3↑+2H2O,浓氨水与碱石灰(或生石灰或NaOH固体)。
(2)氨水成碱性,应用碱性干燥剂干燥氨气,一般可用碱石灰(或生石灰);因此本题答案是:碱石灰(或生石灰)。
(3)氨气的密度比空气小,极易溶于水,采用向下排空气法收集;若用d装置收集氨气,则气体流向为②进①出;NO气体密度比空气略大,不溶于水,易与氧气反应,因此采用排水法收集,应选c;因此,本题答案是:②进①出, c。
(4)若用C装置与d装置相连制取并收集X气体,则在加热条件下制备,且用固体和液体或者液体与液体反应,可用于制备氯气,二氧化硫等,气体有毒,不能排放到空气中,应有尾气处理装置;因此可以制取并收集X气体为③Cl2和④SO2,因此本题选 ③④。
(5)①烧瓶A的压强大,先打开旋塞1,氯化氢气体就会逸散到烧瓶B,与氨气反应生成氯化铵,所以B瓶中的现象是有大量白烟产生;因此本题答案是:产生白烟。
②再打开旋塞2,由于B瓶内气体压强减小,所以烧杯中的液体会倒流进入B瓶中,由于氯化铵溶液显酸性,溶液的颜色变为红色;综上所述,本题答案是:烧杯中的石蕊溶液会倒流进入到B瓶中,形成红色溶液。

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)最高正价为+1价,还能显﹣1价的元素是____(填元素符号);⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为________(填化学式).
(2)③的单质在空气中充分燃烧的化学方程式是________________________________.④与⑥形成的稳定化合物的电子式为______________.
(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为________________,其中含有的化学键类型为_________________.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈___色.⑤的最高价氧化物水化物的稀溶液与金属铜反应的离子方程式为______________________.