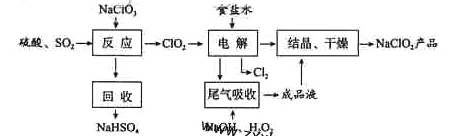
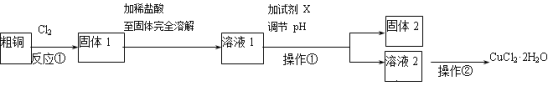
题目内容
【题目】铬用于制不锈钢,汽车零件,工具,磁带和录像带等。铬是人体必需的微量元素,铬的生理功能是与其它控制代谢的物质一起配合起作用,如激素、胰岛素、各种酶类、细胞的基因物质(DNA和RNA)等,但铬在人体内超过一定浓度对人体健康会造成伤害。
(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。
请用离子方程式说明上述除杂的原理__________________。
(2)工业上为了处理含有Cr2O2- 7的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为__________。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH至少为 ,才能使Cr3+低于1×10-5 mol·L-1(国家允许的排放标准之内)。
③现用上述方法处理100m3含铬(+6价)78mgL-1的废水,需用绿矾的质量为 kg。(保留到
小数点后一位)
【答案】(1) FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq)
(2)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
②5
③125.1
【解析】
试题分析:(1)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,故离子方程式为FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq)。
故答案为:FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq);
(2)①工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO47H2O)把废水中的六价铬离子还原
成三价铬离子,Cr2O72-的酸性工业废水中加入硫酸亚铁反应生成铁离子,三价铬离子和水,反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②常温下,Cr3+沉淀完全浓度小于10-5mol/L,Cr(OH)3的溶度积Ksp=1×10-32=c(Cr3+)c3(OH-),c3(OH-)=![]() =10-27,c(OH-)=1×10-9mol/L,依据离子积Kw=c(H+)c(OH-),c(H+)=
=10-27,c(OH-)=1×10-9mol/L,依据离子积Kw=c(H+)c(OH-),c(H+)=![]() =10-5(mol/L),溶液pH=5。
=10-5(mol/L),溶液pH=5。
故答案为:5;
③现用上述方法处理100m3含铬(+6价)78mgL-1的废水,铬元素物质的量=![]() =150mol,Cr2O72-物质的量75mol,则
=150mol,Cr2O72-物质的量75mol,则
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
1 6
75mol 450mol
需用绿矾的质量=450mol×278g/mol=125100g=125.1kg。
故答案为:125.1。

【题目】根据金属活动性顺序表,Cu不能发生反应:Cu+2H2O= Cu(OH)2↓+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的一组是
A | B | C | D | |
阳极 | 石墨棒 | Cu | Cu | Cu |
阴极 | 石墨棒 | Fe | 石墨棒 | Pt |
电解液 | CuSO4溶液 | H2SO4溶液 | Na2SO4溶液 | H2O |
【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
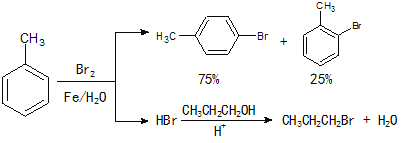
实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如下:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |

(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入 ,以减少溴的挥发。写出甲苯和液溴反应生成对溴甲苯的化学方程式 。
(2)反应装置如图所示:

①图中玻璃仪器a的名称是 , 方块b中为某玻璃仪器,
其名称是 。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和 。加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是 。
(3)操作I的名称是 ,操作Ⅲ的名称是 。
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00 mL,用0.1000 mol·L-1 NaOH溶液滴定,以测定溶液pH。该同学认为无需加入指示剂,也能完成滴定。他提出这一观点的理由是 。