题目内容
电子表中电源常用银—锌微型电池,电极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH- 电池的总反应式为:Ag2O+Zn= 2Ag+ZnO,下列判断不正确的是
| A.锌为负极,Ag2O为正极 |
| B.锌发生还原反应,氧化银发生氧化反应 |
| C.原电池工作时,负极附近溶液的pH值减小 |
| D.原电池工作时,电子流动方向为Zn→Ag2O |
B
解析试题分析:由电池的总反应方程式可知:A.锌为负极,失去电子,被氧化;Ag2O为正极,得到电子,被还原。正确。B.锌作负极,发生氧化反应,氧化银得到电子,发生还原反应。错误。C.在原电池工作时,负极由于不断消耗OH-,所以附近溶液的c(OH-)减小,pH值减小。正确。D.原电池工作时,电子从电池的负极流向电池的正极。即流动方向为Zn→Ag2O。正确。
考点:考查原电池的工作原理的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知空气-锌电池的电极反应:
锌片:Zn-2OH--2e- = ZnO + H2O,石墨:1/2 O2+H2O +2e- = 2OH-
据次推断锌片是
| A.负极,被氧化 | B.负极,被还原 | C.正极,被氧化 | D.正极,被还原 |
在理论上可用于设计原电池的化学反应是
| A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0 |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0 |
| C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0 |
D.FeCl3(aq)十3H2O(1)  Fe(OH)3(s)+3HCl(aq);△H >0 Fe(OH)3(s)+3HCl(aq);△H >0 |
下图是研究铁钉腐蚀的装置图。下列说法不正确的是
| A.ab在两处的腐蚀速率.a<b |
| B.a、b两处铁钉中的碳均为正极 |
| C.a、b两处铁钉中的铁均失电子被氧化 |
| D.a、b两处的正极反应式均为O2+4e-+ 4 H+=2H2O |
如图,有关零排放车载燃料电池叙述正确的是( )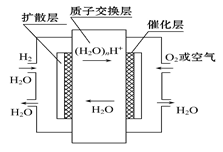
| A.正极通入H2,发生还原反应 |
| B.负极通入H2,发生还原反应 |
| C.导电离子为质子,且在电池内部由正极定向移向负极 |
| D.总反应式为2H2+O2 = 2H2O |
图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是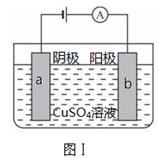

| A.图Ⅰ中a为纯铜 |
| B.图Ⅰ中SO42-向b极移动 |
| C.图Ⅱ中如果a、b间连接电源,则a连接负极 |
| D.图Ⅱ中如果a、b间用导线连接,则X可以是铜 |
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.HCl、CuCl2、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.NaOH、H2SO4、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH--14e-=2CO32-+12H2O。有关此电池的推断不正确的是
| A.通入氧气的电极为正极 |
| B.参加反应的O2与C2H6的物质的量之比为7∶2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.放电一段时间后,正极区附近溶液的pH减小 |
