题目内容
(1)根据物质的量浓度的概念,可以求出纯水的物质的量浓度是______mol?L-
(2)氧气在空气中的体积分数约为0.25,则标况下,空气中氧气的物质的量的浓度是______mol?L-1.
(3)将一定量的MgCl2 溶于90g 水中,是每100个水分子中就有1个Cl-,这一定量的MgCl2的物质的量为______.
解:(1)令水的体积为1L,水的质量为1000mL×1g/mL=1000g,水的物质的量为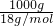 =55.5mol,故纯水的物质的量浓度为
=55.5mol,故纯水的物质的量浓度为 =55.5mol/L;
=55.5mol/L;
故答案为:55.5;
(2)令空气的体积为1L,氧气的体积为1L×0.25=0.25L,氧气的物质的量为 =0.011mol,故空气中氧气的物质的量浓度为
=0.011mol,故空气中氧气的物质的量浓度为 =0.011mol/L;
=0.011mol/L;
故答案为:0.011;
(3)90g水的物质的量为 =5mol,所以n(Cl-)=
=5mol,所以n(Cl-)= =0.05mol,根据氯离子守恒可知n(MgCl2)=
=0.05mol,根据氯离子守恒可知n(MgCl2)= n(Cl-)=
n(Cl-)= ×0.05mol=0.025mol;
×0.05mol=0.025mol;
故答案为:0.025.
分析:(1)令水的体积为1L,根据m=ρV计算水的质量,再根据n= 计算水的物质的量,根据c=
计算水的物质的量,根据c= 计算纯水的物质的量浓度;
计算纯水的物质的量浓度;
(2)令空气的体积为1L,计算氧气的体积,再根据n= 计算氧气的物质的量,根据c=
计算氧气的物质的量,根据c= 计算空气中氧气的物质的量浓度;
计算空气中氧气的物质的量浓度;
(3)根据n= 计算90g水的物质的量,进而计算n(Cl-),根据氯离子守恒可知n(MgCl2)=
计算90g水的物质的量,进而计算n(Cl-),根据氯离子守恒可知n(MgCl2)= n(Cl-),据此计算.
n(Cl-),据此计算.
点评:本题考查常用化学计量的有关计算,比较基础,注意公式的理解与灵活运用.
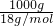 =55.5mol,故纯水的物质的量浓度为
=55.5mol,故纯水的物质的量浓度为 =55.5mol/L;
=55.5mol/L;故答案为:55.5;
(2)令空气的体积为1L,氧气的体积为1L×0.25=0.25L,氧气的物质的量为
 =0.011mol,故空气中氧气的物质的量浓度为
=0.011mol,故空气中氧气的物质的量浓度为 =0.011mol/L;
=0.011mol/L;故答案为:0.011;
(3)90g水的物质的量为
 =5mol,所以n(Cl-)=
=5mol,所以n(Cl-)= =0.05mol,根据氯离子守恒可知n(MgCl2)=
=0.05mol,根据氯离子守恒可知n(MgCl2)= n(Cl-)=
n(Cl-)= ×0.05mol=0.025mol;
×0.05mol=0.025mol;故答案为:0.025.
分析:(1)令水的体积为1L,根据m=ρV计算水的质量,再根据n=
 计算水的物质的量,根据c=
计算水的物质的量,根据c= 计算纯水的物质的量浓度;
计算纯水的物质的量浓度;(2)令空气的体积为1L,计算氧气的体积,再根据n=
 计算氧气的物质的量,根据c=
计算氧气的物质的量,根据c= 计算空气中氧气的物质的量浓度;
计算空气中氧气的物质的量浓度;(3)根据n=
 计算90g水的物质的量,进而计算n(Cl-),根据氯离子守恒可知n(MgCl2)=
计算90g水的物质的量,进而计算n(Cl-),根据氯离子守恒可知n(MgCl2)= n(Cl-),据此计算.
n(Cl-),据此计算.点评:本题考查常用化学计量的有关计算,比较基础,注意公式的理解与灵活运用.

练习册系列答案
相关题目
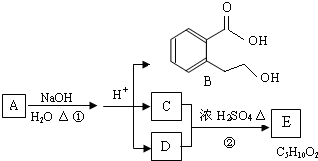

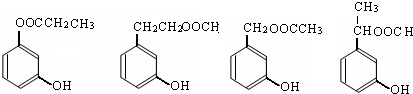 写出四者之一即可
写出四者之一即可