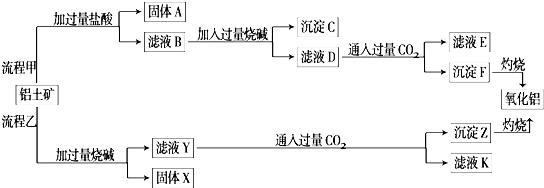
题目内容
11.下列叙述I和II均正确并有因果关系的是( )| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使酸性KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO溶液制备HClO |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯甲酸溶于水,而泥沙不溶于水;
B.氯化铵分解后,极易化合生成氯化铵;
C.SO2能使酸性KMnO4溶液褪色,发生氧化还原反应;
D.用CO2和NaClO溶液制备HClO,发生强酸制取弱酸的反应.
解答 解:A.苯甲酸溶于水,而泥沙不溶于水,则溶于水后过滤可除杂,叙述不具有因果关系,故A错误;
B.氯化铵分解后,极易化合生成氯化铵,则不能利用加热NH4Cl制备NH3,叙述II不合理,故B错误;
C.SO2能使酸性KMnO4溶液褪色,发生氧化还原反应,与二氧化硫的还原性有关,叙述不具有因果关系,故C错误;
D.用CO2和NaClO溶液制备HClO,发生强酸制取弱酸的反应,由碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8可知碳酸酸性强,叙述合理且具有因果关系,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、气体的制备原理、氧化还原反应、酸性比较等,把握物质的性质、化学反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
1.下列说法错误的是( )
| A. | 明矾常作净水剂 | |
| B. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| C. | 在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物 |
2.汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)?N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是( )
| A. | 只要使用合理的催化剂及载体,就可完全清除NO和CO | |
| B. | 使用催化剂只能改变反应的速率不能改变反应的平衡常数 | |
| C. | 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) | |
| D. | 恒容条件下,通入惰性气体可提高NO转化率 |
19.已知一定温度时:N2(g)+3H2 (g)?2NH3(g).当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q.则下列关系式中正确的是( )
| A. | Q=92 kJ | B. | Q<92 kJ | C. | Q>92 kJ | D. | Q=194kJ |
16.碘硫化学循环原理如图1所示.
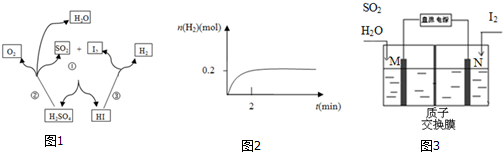
(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为43:7.
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.

(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
20.将Fe、FeO和Fe2O3的混合物m g加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08mol,放出的气体在标准状况下的体积为0.224L,则原混合物中氧元素的质量分数为( )
| A. | 20.5% | B. | 18.6% | C. | 17.6% | D. | 无法计算 |
1.下列物质沸点的比较,错误的是( )
| A. | 丙烷>乙烷 | B. | 丁烷>乙醇 | C. | 苯酚>苯 | D. | 1-氯丙烷>丙烷 |
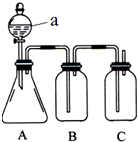 某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液