题目内容
13.单质钛的机械强度高,抗蚀能力强,有“未来金属”之称.工业上常用硫酸分解钛铁矿(FeTiO3)的方法制取二氧化钛,再由二氧化钛制金属钛,主要反应有( )①FeTiO3+3H2SO4═Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O═H2TiO3↓+2H2SO4
③H2TiO3 $\stackrel{△}{→}$TiO2+H2O
④TiO2+2C+2Cl2 $\stackrel{△}{→}$ TiCl4↑+CO↑
⑤TiCl4+2Mg $\stackrel{△}{→}$ 2MgCl2+Ti
下列叙述错误的是( )
| A. | 反应①属于非氧化还原反应 | |
| B. | 反应②是水解反应 | |
| C. | 反应④中二氧化钛是氧化剂 | |
| D. | 反应⑤表现了金属镁还原性比金属钛强 |
分析 A.反应①中没有元素的化合价升降;
B.反应②中水为反应物;
C.反应④中Cl元素的化合价降低,C元素的化合价升高;
D.还原剂的还原性大于还原产物.
解答 解:A.反应①中没有元素的化合价升降,则不属于氧化还原反应,故A正确;
B.反应②中水为反应物,该反应为钛离子的水解反应,故B正确;
C.反应④中Cl元素的化合价降低,C元素的化合价升高,则反应④中TiO2不是氧化剂,故C错误;
D.反应⑤中Mg为还原剂,Ti为还原产物,则金属镁还原性比金属钛强,故D正确;
故选C.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意相关的反应的分类及概念,题目难度不大.

练习册系列答案
 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
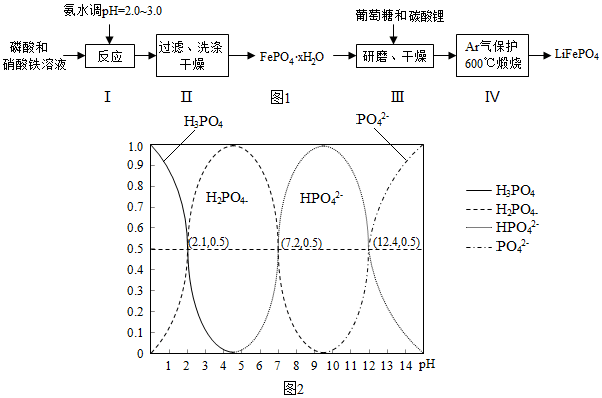
3.锂离子电池是目前具有最高比能量的二次电池.LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择.生产LiFePO4的一种工艺流程如图1:
已知Kap:(FePO4•xH2O)=1.0×10-15,Kap[Fe(OH)3]=4.0×10-30
回答下列问题:
(1)在合成硝酸铁时,步骤I中pH的控制是关键.如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是生成Fe(OH)3杂质,影响磷酸铁的纯度.
(2)步骤II中,洗涤是为了除去FePO4•xH2O表面附着的NO3-、NH4+、H+等离子
(3)取3组FePO4•xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如表:
固体失重质量分数=(样品起始质量-剩余固体质量)/样品起始质量100%,则x=2.1(保留至0.1).
(4)步骤III中研磨的作用是使反应物混合均匀,增大反应速率,提高反应产率.
(5)在步骤IV中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为24:1.
(6)H3PO4是三元酸,图2是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图.则PO42-第一步水解的水解常数K1的表达式为$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$,K1的数值最接近B (填字母).
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2.

已知Kap:(FePO4•xH2O)=1.0×10-15,Kap[Fe(OH)3]=4.0×10-30
回答下列问题:
(1)在合成硝酸铁时,步骤I中pH的控制是关键.如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是生成Fe(OH)3杂质,影响磷酸铁的纯度.
(2)步骤II中,洗涤是为了除去FePO4•xH2O表面附着的NO3-、NH4+、H+等离子
(3)取3组FePO4•xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如表:
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数 | 19.9% | 20.1% | 20.0% |
(4)步骤III中研磨的作用是使反应物混合均匀,增大反应速率,提高反应产率.
(5)在步骤IV中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为24:1.
(6)H3PO4是三元酸,图2是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图.则PO42-第一步水解的水解常数K1的表达式为$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$,K1的数值最接近B (填字母).
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2.
4.对于可逆反应M+N?Q达到平衡时,下列说法正确的是( )
| A. | M、N、Q三种物质的浓度一定相等 | B. | M、N全部变成了Q | ||
| C. | 反应物和生成物的浓度都保持不变 | D. | 正反应和逆反应不再进行 |
1.如图是元素周期表的一部分,下列关系正确的是( )
| S | Cl |
| Se | Br |
| A. | 还原性:Se2->S2->Cl- | B. | 热稳定性:HCl>H2Se>HBr | ||
| C. | 原子半径:Se>Cl>S | D. | 酸性:HBrO4>HClO4>H2SeO4 |
8.宏观物质是由微粒构成的,微粒之间存在相互作用,下列说法错误的是( )
| A. | 食盐是由Na+和Cl-通过离子键形成的离子化合物 | |
| B. | Si与C同属ⅣA族,因此SiO2和CO2两种物质中微粒间作用完全相同 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 冰中H2O分子间存在氢键、H2O分子内存在极性共价键 |
18.反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.8mol•L-1.对该化学反应速率的表示正确的是( )
| A. | 用A表示的化学反应速率是0.4 mol•(L•min)-1 | |
| B. | 分别用B、C、D表示化学反应速率的比值是3:2:1 | |
| C. | 在2 min末的反应速率,用B表示是0.4 mol•(L•min)-1 | |
| D. | 在这2 min内,用B和C表示的化学反应速率的值都是逐渐减小的 |
2.(1) 表示某带电微粒的结构示意图,则可用它表示的阳离子中原子序数最大的是(写离子符号)Al3+
表示某带电微粒的结构示意图,则可用它表示的阳离子中原子序数最大的是(写离子符号)Al3+
(2)短周期元素X能形成H2X和XO2两种化合物,该元素的原子序数是16
(3)下表中,G元素原子最容易与哪种元素的原子间反应形成离子键NaCl (填离子化合物的化学式)
(4)在下图各装置的容器(分别用符号A~E表示)中盛海水,铁会在其中发生变化.其中铁作阳极的是D (用装置符号填空)

 表示某带电微粒的结构示意图,则可用它表示的阳离子中原子序数最大的是(写离子符号)Al3+
表示某带电微粒的结构示意图,则可用它表示的阳离子中原子序数最大的是(写离子符号)Al3+(2)短周期元素X能形成H2X和XO2两种化合物,该元素的原子序数是16
(3)下表中,G元素原子最容易与哪种元素的原子间反应形成离子键NaCl (填离子化合物的化学式)
| 原子 | a | b | c | d | e | f | G |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |

 二氧化碳:
二氧化碳: 过氧化钠:
过氧化钠: .
.