题目内容
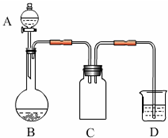 (2012?南京模拟)实验室一般用回收的粗铜屑(含少量Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4?5H2O晶体,反应可在如图所示装置中进行.
(2012?南京模拟)实验室一般用回收的粗铜屑(含少量Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4?5H2O晶体,反应可在如图所示装置中进行.回答下列问题:
(1)C装置的作用是
起到安全瓶的作用,防止D中溶液倒吸到反应装置B中
起到安全瓶的作用,防止D中溶液倒吸到反应装置B中
.(2)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气,吸收液与尾气发生反应的离子方程式为
3ClO-+NO+2OH-═3Cl-+2NO3-+H2O
3ClO-+NO+2OH-═3Cl-+2NO3-+H2O
.(3)准确称取上述粗铜屑(设仅含Cu和Cu2O)3.28g,与足量稀硝酸充分反应,得到无色气体672.0mL(标准状况下).计算样品中Cu单质的质量分数(计算结果精确到小数点后两位).
分析:(1)根据C装置防止D中溶液倒吸到反应装置B中进行分析;
(2)次氯酸根离子具有氧化性,将一氧化氮氧化成了硝酸根离子;
(3)设含铜的物质的量为xmol,氧化亚铜的物质的量为ymol,根据质量关系和电子守恒列式计算出铜的物质的量,再计算出铜的质量分数.
(2)次氯酸根离子具有氧化性,将一氧化氮氧化成了硝酸根离子;
(3)设含铜的物质的量为xmol,氧化亚铜的物质的量为ymol,根据质量关系和电子守恒列式计算出铜的物质的量,再计算出铜的质量分数.
解答:解:(1)反应中装置B内压强减小,容易将C中液体倒吸入装置B中,所以C起到了安全瓶的作用,
故答案为:起到安全瓶的作用,防止D中溶液倒吸到反应装置B中;
(2)由于次氯酸根离子具有氧化性,将一氧化氮氧化成了硝酸根离子,反应的离子方程式为:3ClO-+NO+2OH-═3Cl-+2NO3-+H2O,
故答案为:3ClO-+NO+2OH-═3Cl-+2NO3-+H2O;
(3)产生一氧化氮气体的物质的量为:0.03mol
设含铜的物质的量为xmol,氧化亚铜的物质的量为ymol,
64x+144y=3.28g,
2x+2y=0.03×3
解得x=0.04mol,y=0.005mol,
铜单质的质量分数为:
=0.78,
答:样品中Cu单质的质量分数为0.78.
故答案为:起到安全瓶的作用,防止D中溶液倒吸到反应装置B中;
(2)由于次氯酸根离子具有氧化性,将一氧化氮氧化成了硝酸根离子,反应的离子方程式为:3ClO-+NO+2OH-═3Cl-+2NO3-+H2O,
故答案为:3ClO-+NO+2OH-═3Cl-+2NO3-+H2O;
(3)产生一氧化氮气体的物质的量为:0.03mol
设含铜的物质的量为xmol,氧化亚铜的物质的量为ymol,
64x+144y=3.28g,
2x+2y=0.03×3
解得x=0.04mol,y=0.005mol,
铜单质的质量分数为:
| 0.04×64 |
| 3.28 |
答:样品中Cu单质的质量分数为0.78.
点评:本题考查了用粗铜屑制取硫酸铜晶体方法,主要考查了仪器的作用、离子方程式的书写及铜质量分数的计算,本题难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目





 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).