题目内容
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、1L 1mol?L-1的Na2CO3 溶液中含有CO32-的数目为NA |
| B、25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA |
| D、1mol Fe与足量的稀HNO3反应,转移2NA个电子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.碳酸钠溶液中,碳酸根离子部分水解,导致溶液中碳酸根离子数目减少;
B.缺少氢氧化钠溶液的体积,无法计算溶液中氢氧根离子的数目;
C.钠为1价金属,2.3g钠的物质的量为0.1mol,完全反应失去0.1mol电子;
D.稀硝酸足量,1mol铁完全反应失去3mol电子.
B.缺少氢氧化钠溶液的体积,无法计算溶液中氢氧根离子的数目;
C.钠为1价金属,2.3g钠的物质的量为0.1mol,完全反应失去0.1mol电子;
D.稀硝酸足量,1mol铁完全反应失去3mol电子.
解答:
解:A.1L 1mol?L-1的Na2CO3溶液中含有溶质碳酸钠1mol,由于碳酸根离子部分水解,溶液中碳酸根离子的物质的量小于1mol,含有CO32-的数目小于NA,故A错误;
B.没有告诉氢氧化钠溶液的体积,无法计算该氢氧化钠溶液中含有的氢氧根离子数目,故B错误;
C.2.3g钠的物质的量为0.1mol,0.1mol钠完全反应失去0.1mol电子,失去的电子数一定为0.1NA,故C正确;
D.Fe与足量的稀HNO3反应生成铁离子,1mol铁失去3mol电子,转移了3NA个电子,故D错误;
故选C.
B.没有告诉氢氧化钠溶液的体积,无法计算该氢氧化钠溶液中含有的氢氧根离子数目,故B错误;
C.2.3g钠的物质的量为0.1mol,0.1mol钠完全反应失去0.1mol电子,失去的电子数一定为0.1NA,故C正确;
D.Fe与足量的稀HNO3反应生成铁离子,1mol铁失去3mol电子,转移了3NA个电子,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项B为易错点,注意缺少溶液体积.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
 某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )| A、如图条件下实验过程中没有热量损失 |
| B、若改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,通过测定反应过程中所放出的热量相等 |
| C、图中实验装置缺少环形玻璃搅拌棒 |
| D、烧杯间填满碎纸条的作用是固定小烧杯 |
下图所示的实验装置或操作合理的是( )
A、 制氨气 |
B、 蒸发、结晶 |
C、 萃取碘 |
D、 酸碱中和滴定 |
下列离子方程式书写正确的是( )
| A、偏铝酸钠中通足量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、氯化铝溶液与足量氨水反应:Al3++4OH-═AlO2-+2H2O |
| C、氯化铝溶液与足量NaOH溶液反应:Al3++3OH-═Al(OH)3↓ |
| D、氧化铝和适量的烧碱溶液反应:Al2O3+2OH-═2AlO2-+H2O |
下列离子方程式正确的是( )
| A、氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | ||||
| B、在AgCl沉淀中加入碘化钾溶液:AgCl(s)+I-(aq)═AgI (s)+Cl-(aq) | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
D、电解氯化镁溶液:2Cl-+2H2O
|
奥运会火炬所用燃料的主要成分.一般都是丙烷,下列关于丙烷的叙述不正确的是( )
| A、分子中碳原子不在一条直线上 |
| B、比丁烷更易液化 |
| C、光照下能够发生氯代反应 |
| D、是石油分馏的一种产品 |
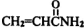 )具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.
)具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.