��Ŀ����
20�� �����ѣ�Ti3N4��Ϊ���ɫ���壬���ھ�����������ķ½�Ч����Խ��Խ��س�Ϊ�ƽ�Ĵ���Ʒ����TiCl4Ϊԭ�ϣ�����һϵ�з�Ӧ����ͼ1��ʾ�������Ƶ�Ti3N4��TiO2��
�����ѣ�Ti3N4��Ϊ���ɫ���壬���ھ�����������ķ½�Ч����Խ��Խ��س�Ϊ�ƽ�Ĵ���Ʒ����TiCl4Ϊԭ�ϣ�����һϵ�з�Ӧ����ͼ1��ʾ�������Ƶ�Ti3N4��TiO2��ͼ1�е�M�Ƕ����ڽ���Ԫ�أ�M�IJ��ֵ������±���
| I1 | I2 | I3 | I4 | I5 | |
| ������/KJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
��2����̬Ti3+��δ�ɶԵ�������1����Ti�Ļ�̬ԭ����Χ�����Ų�ʽΪ4d25s2��
��3������TiO2��һ��Ӧ�ù㷺�Ĵ���������TiO2����һ��ʵ����ͼ2��ʾ��������ķ���ʽ�в�ȡsp2�ӻ���̼ԭ����Ϊ7�����������в�ȡsp3��ʽ�ӻ���ԭ�Ӷ�Ӧ��Ԫ�صĵ縺���ɴ�С��˳��ΪO��N��C��
��4����һ�ֵ����Ѿ���ľ�����NaCl���ƣ���ͼ3��ʾ���þ�������Nԭ�Ӿ�������������Nԭ����12�����þ���Ļ�ѧʽΪTiN��
���� ��1��M�Ƕ����ڽ���Ԫ�أ�M�ĵ��������ܾ��������ڢ�A�壬����TiCl4��Ӧ�û���Ti����MΪMg��Mg���������������ܶѻ���
��2��TiΪ22��Ԫ�أ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63S23p63d24s2����Χ�����Ų�Ϊ3d24s2��ʧȥ4s�ܼ�2�����ӡ�3d�ܼ�1�������γ�Ti3+��
��3����ȡsp2�ӻ���̼ԭ�Ӽ۲���Ӷ�����3�����ݼ۲���Ӷ����жϣ���ȡsp3�ӻ���ԭ�Ӽ۲���Ӷ�����4�����в�ȡsp3�ӻ���ԭ����C��N��O��ͬһ����Ԫ���У�Ԫ�صĵ縺������ԭ������������
��4�����ݾ�̯�����㾧����Ti��Nԭ����Ŀ���������㾧����ѧʽ���Ծ�������Nԭ���о�����֮��������������Nԭ�Ӵ�������λ�ã�
��� �⣺��1��M�Ƕ����ڽ���Ԫ�أ�M�ĵ��������ܾ��������ڢ�A�壬����TiCl4��Ӧ�û���Ti����MΪMg��Mg���������������ܶѻ�����λ��Ϊ12���ʴ�Ϊ��Mg���������ܶѻ���12��
��2��TiΪ22��Ԫ�أ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63S23p63d24s2��ʧȥ4s�ܼ�2�����ӡ�3d�ܼ�1�������γ�Ti3+����̬Ti3+���Ӻ�������Ų�Ϊ1s22s22p63S23p63d1��3d�ܼ�1������Ϊδ�ɶԵ��ӣ��ʴ�Ϊ��1��4d25s2��
��3��������ķ����в�ȡsp2�ӻ���̼ԭ��Ϊ�������ϵ��������ʻ��е�һ������7������ȡsp3�ӻ���ԭ�Ӽ۲���Ӷ�����4�����в�ȡsp3�ӻ���ԭ����C��N��O��ͬһ����Ԫ���У�Ԫ�ص縺������ԭ�������������ӵ縺���������������ǵĵ縺�Թ�ϵΪ��O��N��C���ʴ�Ϊ��7�� O��N��C��
��4�����ݾ�̯������֪�þ�����Nԭ�Ӹ���Ϊ��6��$\frac{1}{2}$+8��$\frac{1}{8}$=4���þ�����Tiԭ�Ӹ���Ϊ��1+12��$\frac{1}{4}$=4�������Ļ�ѧʽΪTiN���Ծ�������Nԭ���о�����֮��������������Nԭ�Ӵ�������λ�ã�ÿ������Ϊ8���������ã�ÿ����Ϊ2���������ã�����֮��������������Nԭ��Ϊ$\frac{3��8}{2}$=12���ʴ�Ϊ��12��TiN��
���� ���⿼�����ʽṹ�����ʣ��漰�����ṹ����㡢��������Ų����ӻ���ʽ���縺�ԱȽϵȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�

| A�� |  | B�� |  | C�� |  | D�� |  |
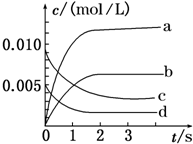 ��2L�ܱ������ڣ�800��ʱX��g����Y��g����Ӧ����Z��g������ϵ�У�n��X����ʱ��ı仯�����ʾ������֪��2X��g��+Y��g��?2Z��g�� ��
��2L�ܱ������ڣ�800��ʱX��g����Y��g����Ӧ����Z��g������ϵ�У�n��X����ʱ��ı仯�����ʾ������֪��2X��g��+Y��g��?2Z��g�� ��| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n��X��/mol | 0.020 | 0.010 | 0.008 | 0.008 | 0.008 | 0.008 |
��2����ͼ�б�ʾZ�仯���ߵ���b����Y��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v=1.5��10-3mol•L-1•s-1��
���������м������ϡH2SO4�����ˣ�
������Һ�м������KMnO4��Һ��������Һ��pHԼΪ3��
���ȣ�����������ɫ���������ã��ϲ���Һ���Ϻ�ɫ��
��������MnSO4���Ϻ�ɫ��ʧ�����ˣ�
����Ũ�����ᾧ�����룬�õ���Ʒ��
��1��H2SO4�ܽ�A12O3�����ӷ���ʽ��Al2O3+6H+=2Al3++3H2O
��2��KMnO4����Fe2+�����ӷ���ʽ����������
1MnO4+5Fe2++8H+=1Mn2++5Fe3++4H2O
��3����֪��
�����������������pH
| Al��OH��3 | Fe��OH��2 | Fe��OH��3 | |
| ��ʼ����ʱ | 3.4 | 6.3 | 1.5 |
| ��ȫ����ʱ | 4.7 | 8.3 | 2.8 |
���ݱ������ݽ��Ͳ�����Ŀ�ģ���ȥ��Ԫ��
��4����֪��һ�������£�MnO4-����Mn2+��Ӧ����MnO2��
�����ij����м���ŨHCI�����ȣ���˵�������д���MnO2��������Ũ������MnO2�������ɻ���ɫ����Cl2�����ж�MnO2�Ƿ���ڣ�
�ڢ��м���MnSO4��Ŀ���dz�ȥ������MnO4-��
 ����������ԭ��Ӧ��2Ag+��aq��+Zn��s���TZn2+��aq��+2Ag��s����Ƶ�ԭ�����ͼ��ʾ����ش��������⣺
����������ԭ��Ӧ��2Ag+��aq��+Zn��s���TZn2+��aq��+2Ag��s����Ƶ�ԭ�����ͼ��ʾ����ش��������⣺