题目内容
11.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | CO2通过Na2O2使其增重b g时,反应中转移电子数为bNA/44 | |
| B. | 18 g D2O中含有质子的数目为NA | |
| C. | 12 g C3H6 与 16 g C2H4的混合物完全燃烧,可生成CO2分子数为2 NA | |
| D. | 0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成 0.1 NA个胶粒 |
分析 A.根据质量差计算出生成的氧气的物质的量及转移的电子数;
B.重水的摩尔质量为20g/mol,18g重水的物质的量为0.9mol,重水中含有10个质子、10个电子;
C.依据$n=\frac{m}{M}$计算即可;
D.胶体为许多分子的聚合体.
解答 解:A.2mol二氧化碳与过氧化钠反应生成1mol氧气,固体的质量增加56g,固体质量增加bg,生成的氧气的物质的量为:1mol×$\frac{b}{56}$,转移的电子的物质的量为$\frac{b}{56}$×2=$\frac{b}{28}$mol,故A错误;
B.18g重水的物质的量为0.9mol,0.9mol重水中含有9mol质子、9mol电子,含有的质子数和电子数均为9NA,故B错误;
C.12g C3H6完全燃烧产生二氧化碳的物质的量n=$\frac{12g}{42g/mol}×3$=$\frac{6}{7}$mol,16 g C2H4完全燃烧产生二氧化碳的物质的量n=$\frac{16g}{28g/mol}$×2=$\frac{8}{7}$mol,两者的和=$\frac{6}{7}+\frac{8}{7}$=2mol,故C正确;
D.氢氧化铝胶粒是许多氢氧化铝微粒的聚集体,故0.1molAlCl3完全水解转化为氢氧化铝胶体,生成胶粒数小于0.1NA,故D错误,故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.2.0mol H2和1.0mol I2(g)充入体积不变的密闭容器中,在一定条件下发生下述反应:H2(g)+I2(g)?2HI(g),达平衡时,HI为0.40mol,如果此时移走1.0mol H2和0.50mol I2(g),在相同温度下再达到平衡时,HI的物质的量是( )
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20mol | D. | 大于0.20 mol,小于0.40 mol |
2.下列反应的离子方程式书写正确的是( )
| A. | 向四氧化三铁中加入稀硫酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2至沉淀质量最大Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4+2H2O | |
| C. | 向CuSO4溶液中加入金属钠:2Na+Cu2+═2Na ++Cu | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
6.质量分数为15%的硫酸溶液18毫升,密度为1.102g•mL-1,则它的物质的量浓度最接近下列数值中的( )
| A. | 1.685mol•L-1 | B. | 3.370 mol•L-1 | C. | 22.49 mol•L-1 | D. | 11.24 mol•L-1 |
3.下列离子组在溶液中能大量共存的是( )
| A. | H+、Fe2+、Cl-、NO3- | B. | K+、H+、CO32-、HCO3- | ||
| C. | Ca2+、Ba2+、Cl-、HCO3- | D. | Na+、Ba2+、HCO3-、OH- |
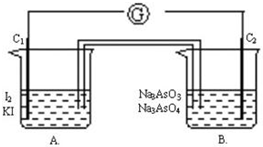 根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.
根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.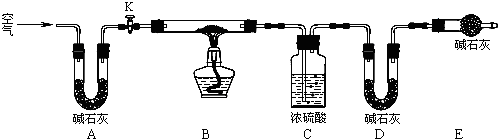
 .
.
 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; .
.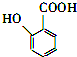 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是 .
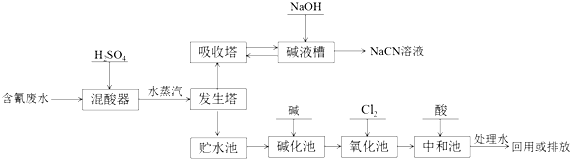
.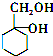 的合成路线流程图(自选无机试剂).合成路线流程图示例:
的合成路线流程图(自选无机试剂).合成路线流程图示例: