题目内容
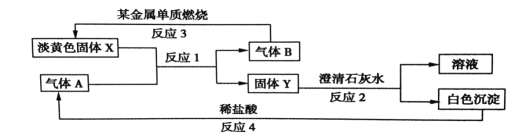
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物。用过氧化氢法生产亚氯酸钠的工艺流程如下:
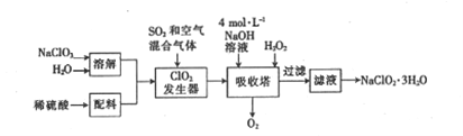
已知:①NaClO2的溶解度随温度的升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②Ksp(FeS)=6.3×10-18;Ksp(CuS)= 6.3×10-36;Ksp(PbS)=2.4×10-28。
(1)发生器中反应的还原剂是_________(填化学式,下同)。吸收塔内ClO2在碱性条件下与H2O2生成NaClO2 的离子方程式为_______
(2)从滤液中得到的NaClO2·3H2O的操作依次是_______、(填字母)、洗染、干燥。
a.蒸馏 b.灼烧 c.冷却结晶 d.蒸发浓缩 e.过滤
(3)亚氯酸钠漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数。
弱酸 | HClO2 | HF | HCN | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,物质的量浓度相同的NaF、NaCN 两种溶液的PH由大到小的顺序为________。
②等体积等物质的量浓度的HClO2与NaOH溶液充分反应后,溶液中各离子浓度由大到小的顺序为_____。
③Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后最先析出的沉淀是______;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-l),此时体系中S2-的浓度为________。
【答案】 SO2 ;2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2↑ dce NaCN>NaF c(Na+)>c(ClO2-)>c(OH-)>c(H+) CuS 6.3×10-13mol·L-1
【解析】(1)由流程图可以知道ClO2发生器中目的是产生ClO2, SO2具有还原性,将ClO3-还原为ClO2,自身被氧化为SO42-, SO2作还原剂;吸收塔内的物质为ClO2、NaOH、H2O2,发生氧化还原反应,发生的离子方程式为2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2↑;答案为: SO2 、2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2↑
(2)制备晶体需要经过的操作依次是加热蒸发、冷却结晶、过滤、洗涤等;答案为:dce
(3)电离平衡常数越大,酸性越强,电离平衡常数越小,酸性越弱,根据电离平衡常数可以知道酸性强弱顺序为: HClO2 >HF >H2S>HCN> HS-;①酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,故物质的量浓度相等的各溶液pH关系为:NaCN>NaF②等体积等物质的量浓度的HClO2与NaOH溶液充分反应后,刚好生成NaClO2,是一种强碱弱酸盐,水解显碱性,溶液中各离子浓度由大到小的顺序为c(Na+)>c(ClO2-)>c(OH-)>c(H+);③Ksp(FeS)=6.3×10-18;Ksp(CuS)= 6.3×10-36;Ksp(PbS)=2.4×10-28物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS;最后析出沉淀是FeS,当最后一种离子沉淀完全时(该离子浓度为![]() ,此时的S2-的浓度为C(S2-)=
,此时的S2-的浓度为C(S2-)= =
=![]() =6.3×10-13mol·L-1
=6.3×10-13mol·L-1
答案为:① >②c(Na+)>c(ClO2-)>c(OH-)>c(H+)③CuS; 6.3×10-13mol·L-1;

 全优点练单元计划系列答案
全优点练单元计划系列答案