题目内容
水滑石(MgaAlb(OH)c(CO3)d·xH2O)用作阻燃剂及催化剂的载体
(1)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为 。
(2)为确定水滑石的组成,进行如下实验:取水滑石样品60.2g进行加热时,温度与剩余固体质量的关系如图。认真分析图中曲线变化情况回答下列问题(已知样品在400℃时已完全失水)
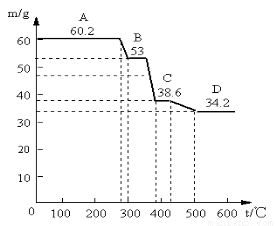
①当温度在0~280℃质量不变,是什么原因: 。C→D减少的物质其物质的量为
②该水滑石的化学式为 (写出计算过程)
(1)2a+3b=c+2d
(2)①水滑石具有阻燃作用,受热分解需吸收大量热量 0.1mol
②Mg6Al2(OH)16CO3·4H2O(计算过程略)
【解析】
试题分析:(1)MgaAlb(OH)c(CO3)d·xH2O中镁为+3价,铝为+3价,氢氧根为—1价,碳酸根为—2价,根据化合价规则判断a、b、c、d的代数关系式为2a+3b=c+2d;(2)根据题给信息知,水滑石可用作阻燃剂,当温度在0~280℃质量不变,原因是水滑石具有阻燃作用,受热分解需吸收大量热量;结合水滑石的组成,分析题给热重曲线知,固体由60.2g变为53g,为失去结晶水的过程,质量为7.2g,物质的量为0.4mol;固体由53g 变为38.6g,为氢氧化铝和氢氧化镁加热生成氧化物和水的过程,水的质量为14.4g,物质的量为0.8mol,则氢氧根为1.6mol;C→D段为失去二氧化碳的过程,质量为4.4g,物质的量为0.1mol,则碳酸根为0.1mol;剩余固体为氧化铝和氧化镁的混合物,质量为34.2g,根据化合价规则和原子守恒确定,氧化铝为0.1mol,氧化镁为0.6mol,综合上述分析知该物质的化学式为Mg6Al2(OH)16CO3·4H2O
考点:考查物质组成的确定、热重曲线的分析。

 阅读快车系列答案
阅读快车系列答案| A、硅胶多孔,吸附水份能力强,所以常用作袋装食品的干燥剂 | B、“煤制油”是不可能实现的,“煤制油”属于伪科学 | C、烟气脱硫是防治酸雨的一种有效措施 | D、天然气属于高效清洁燃料 |
E~N等元素在周期表中的相对位置如下表。E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是
E |
|
|
| K |
F | G |
| M | L |
| H |
| N |
|
A.K的氢化物水溶液显碱性
B.F的单质与氧气反应只生成一种氧化物
C.H与N的原子核外电子数相差14
D.最高价氧化物的水化物酸性:K > L > M
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
C | 用洁净铂丝蘸取某溶液置于酒精灯火焰上灼烧 | 火焰呈黄色 | 溶液中含Na+,无K+ |
D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
 物质
物质 CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)