题目内容
某实验小组的同学为探究铁及其化合物的性质,进行了如下实验,请按照要求回答下列问题: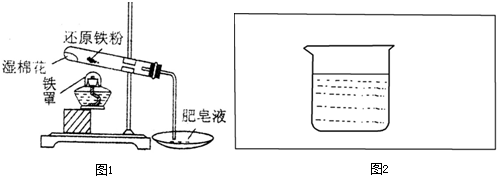
(1)甲同学为了探究铁与水是否反应,先向一只试管中加入少量还原铁粉和适量蒸馏水,观察现象;然后再将其加热,观察现象.根据上述实验,得出的结论是
(2)乙同学在一块覆满铜的绝缘板上,用熔化的蜡写了个字,待蜡凝固后,将绝缘板浸没在盛有FeCl3溶液的小烧杯中,再将小烧杯放入盛有热水的大烧杯中.一段时间后,用镊子取出绝缘板,用水冲洗后除去蜡,发现只有字迹处留有亮红色的铜.实验中热水的作用是
(3)丙同学想利用FeCl3溶液、铁棒、碳棒、导线、烧杯、电流计(用“
 ”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).(4)丁同学利用如图1装置,进行铝热反应的实验.若生成a g铁,至少需要还原剂的物质的量为
(2)石蜡对铜起到保护作用,没被保护的铜浸没在FeCl3溶液中被Fe3+氧化为铜离子,温度升高化学反应速率加快;
(3)自发的氧化还原反应为:2Fe3++Fe=3Fe2+,因此铁棒作负极,碳棒作正极,电解质溶液为氯化铁溶液;
(4)由铁的质量求出物质的量,根据Fe2O3+2Al
| ||
| ||
湿棉花在加热时能够提供水蒸气,
故答案为:铁不能与冷水、热水反应;为反应提供水蒸气;3Fe+4H2O(g)
| ||
(2)温度升高化学反应速率加快,因此实验中热水的作用是加快化学反应速率,Fe3+与Cu发生反应生成铜离子和亚铁离子,离子方程式为:2Fe3++Cu=Cu2++2Fe2+,Fe3+作氧化剂,
故答案为:加快化学反应速率;氧化;
(3)自发的氧化还原反应为:2Fe3++Fe=3Fe2+,因此铁棒作负极,碳棒作正极,电解质溶液为氯化铁溶液,因此装置图为
 ,
,故答案为:
 ;
;(4)Fe的物质的量为n(Fe)=
| ag |
| 56g/mol |
| a |
| 56 |
| ||
| a |
| 56 |
| a |
| 56 |
故答案为:
| a |
| 56 |

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案(16分)某实验小组用浓盐酸和MnO2制取并探究Cl2化学性质,设计装置图如下图所示:

A B C D
(1)A是氯气发生装置(省略未画),制备Cl2的化学反应离子方程式是 ,A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有 。
(2)从C装置出来的气体中含有CO2和HCl,则在C装置中发生的化学反应方程式为
。
(3)同学们在实验中发现,若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成,于是开始探
究该条件下不能生成氯气的原因。
①提出合理假设
假设1:H+的浓度不够大;
假设2: ;
假设3:_________________________ _ 。
②设计实验方案,进行实验。在答题卷上写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓H2SO4、NaCl固体、MnO2固体、1mol/L稀盐酸、1mol/LAgNO3溶液、淀粉-KI溶液
|
实验步骤 |
预期现象与结论 |
|
步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2,
。 |
|
|
步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2,
。 |
|
