题目内容
【题目】回答下列问题:
(1) 碳、氮、氧三元素的第一电离能由小到大的顺序为______________(用元素符号及“ < ”表示);碳、氮、氧三元素的电负性由小到大的顺序为_____________(用元素符号及“ < ”表示)。
(2) N3-的立体构型是___________形;与N3-互为等电子体的一种分子是___________(填分子式)。
(3)在元素周期表中铍和铝被称为“对角线规则”,请写出铍的氧化物和氢氧化物分别与氢氧化钠溶液反应的离子方程式___________________ ,______________________ 。
(4)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
【答案】C<O<N C< N < O 直线 N2O或CO2或BeCl2 BeO+2OH- ===BeO2- + H2O Be(OH) 2 +2OH- ===BeO22- +2 H2O 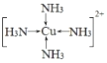 两种离子的中心硫原子均为sp3杂化, SO42-中没有孤对电子,SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小
两种离子的中心硫原子均为sp3杂化, SO42-中没有孤对电子,SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小
【解析】
(1) 同周期自左而右,第一电离能呈增大趋势,但氮元素的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能,所以第一电离能氮>氧>碳,同周期元素从左向右,电负性逐渐增大,则碳、氮、氧三元素的电负性由小到大的顺序为:C<N<O,
故答案为:C<O<N,C< N < O;
(2) N3-含有三个原子22个电子,与其等电子体的分子有N2O或CO2或CS2或BeCl2,N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的结构,二氧化碳是直线型分子,所以N3-的空间构型是直线形.
故答案为:直线;N2O或CO2或CS2或BeCl2;
(3)在元素周期表中铍和铝被称为“对角线规则”,金属铍与铝的单质及其化合物性质相似,则BeO与NaOH溶液反应生成Na2BeO2和水,离子反应为BeO+2OH- ===BeO2- + H2O,Be(OH)2与NaOH溶液反应生成Na2BeO2和水,离子反应方程式为:Be(OH) 2 +2OH- ===BeO22- +2 H2O,
故答案为:BeO+2OH- ===BeO2- + H2O;Be(OH) 2 +2OH- ===BeO22- +2H2O;
(4)生成的配合物[Cu(NH3)4]SO4中的阳离子为:[Cu(NH3)4]2+,其中N原子和铜原子之间存在配位键,阳离子结构式为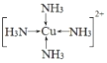 ,SO42-的价层电子对数=4+
,SO42-的价层电子对数=4+![]() (6-2×4+2)=4,即SO42-的中心原子S是sp3杂化,不含有孤电子对,SO32-的价层电子对数=3+
(6-2×4+2)=4,即SO42-的中心原子S是sp3杂化,不含有孤电子对,SO32-的价层电子对数=3+![]() (6-2×3+2)=4,即SO32-的中心原子S是sp3杂化,且含有1个孤电子对,孤电子对对成键电子有挤压作用,因此键角更小,
(6-2×3+2)=4,即SO32-的中心原子S是sp3杂化,且含有1个孤电子对,孤电子对对成键电子有挤压作用,因此键角更小,
故答案为:两种离子的中心硫原子均为sp3杂化, SO42-中没有孤对电子,SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小。