题目内容
(15分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空:
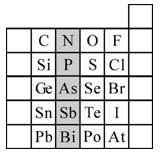
(1)所示元素中
①非金属性最强的元素是:
②金属性最强的元素是:
③原子半径最小的是:
④最高价含氧酸酸性最强的是
⑤经常用作半导体材料的元素是: (只写一种)
⑥阴影部分属于元素周期表中的 族,该族元素的最高正价均为
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S HCl
③沸点:HF HCl
④还原性:I- Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:
A. 常温下Se单质是气体
B. Se最高价氧化物的水化物能和NaOH发生反应
C. 氢化物的化学式为H2Se
D. 常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________

(1)所示元素中
①非金属性最强的元素是:
②金属性最强的元素是:
③原子半径最小的是:
④最高价含氧酸酸性最强的是
⑤经常用作半导体材料的元素是: (只写一种)
⑥阴影部分属于元素周期表中的 族,该族元素的最高正价均为
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S HCl
③沸点:HF HCl
④还原性:I- Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:
A. 常温下Se单质是气体
B. Se最高价氧化物的水化物能和NaOH发生反应
C. 氢化物的化学式为H2Se
D. 常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
(反应方程式2分,其余每空1分,共15分)
(1)① F ② Pb ③ F ④ HClO4 ⑤Si 或Ge (任一种即可) ⑥ⅤA +5
(2)①H3AsO4 < H3PO4; ②H2S < HCl ③HF > HCl
④I- > Br- ⑤ D
(3)① BC ②Br2+2H2O+SO2==4H+ + SO42-+2Br-
(1)① F ② Pb ③ F ④ HClO4 ⑤Si 或Ge (任一种即可) ⑥ⅤA +5
(2)①H3AsO4 < H3PO4; ②H2S < HCl ③HF > HCl
④I- > Br- ⑤ D
(3)① BC ②Br2+2H2O+SO2==4H+ + SO42-+2Br-
略

练习册系列答案
相关题目
 程式
程式 ;
; 合成了具有独特化学特性的E2A6化合物,该物质在D2中能烧,写出它在D2中完全燃烧的化学方程式 .
合成了具有独特化学特性的E2A6化合物,该物质在D2中能烧,写出它在D2中完全燃烧的化学方程式 .

 a、2412Mg、73Li、146C中, 和 互为同位素。表示核素的符号共 种。
a、2412Mg、73Li、146C中, 和 互为同位素。表示核素的符号共 种。