题目内容
t℃时,甲、乙两个烧杯中各盛有100g(密度为1.10g?cm-3)相同浓度的KCl溶液.现将甲烧杯中的溶液蒸发掉35.0gH2O,恢复到t℃时,析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g.下列说法正确的是
- A.原溶液的质量分数为20%
- B.t℃时,KCl的溶解度为50.0g
- C.原溶液的物质的量浓度为3.0mol?L-1
- D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
B
分析:甲乙两烧杯中的溶液由不饱和转变成饱和溶液溶剂相差10.0g,溶质相差5.0g,5.0g溶质溶解在10g溶剂中所形成的溶液为饱和溶液.由此可知该温度下的溶解度为50.0g.根据溶解度可求出原溶液的溶质为25.0g,所以原溶液的质量分数为25%,代入可知浓度为c=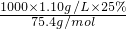 =3.7mol?L-1,两烧杯中剩余溶液均为饱和溶液,质量分数相等.
=3.7mol?L-1,两烧杯中剩余溶液均为饱和溶液,质量分数相等.
解答:A.设原100gKCl溶液中含溶质KCl的质量为xg,根据饱和溶液中的溶解度计算公式得下列关系式:
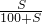 =
= =
=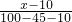 ,解得x=25 g,所以原KCl溶液的质量分数为
,解得x=25 g,所以原KCl溶液的质量分数为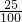 ×100%=25%,故A错误;
×100%=25%,故A错误;
B.据题意得,蒸发35.0g水析出KCl固体5.0g,蒸发45.0g水析出KCl固体10.0g,推断出蒸发10.0g水析出KCl固体5.0 g,故100g水中溶有50g KCl固体得到饱和溶液,即KCl的溶解度为50g,故B正确;
C.原溶液的质量分数为25%,代入可知浓度为c=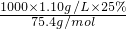 =3.7mol?L-1,故C错误;
=3.7mol?L-1,故C错误;
D.甲、乙烧杯中蒸发水后均有KCl固体析出,说明均已达到饱和,此时质量分数相伺,故D错误.
故选B.
点评:本题考查溶解度的有关问题,考查学生的思维能力,题目难度中等,注意根据根据溶液和溶质质量变化计算溶液的质量分数和溶解度为解答该题的关键.
分析:甲乙两烧杯中的溶液由不饱和转变成饱和溶液溶剂相差10.0g,溶质相差5.0g,5.0g溶质溶解在10g溶剂中所形成的溶液为饱和溶液.由此可知该温度下的溶解度为50.0g.根据溶解度可求出原溶液的溶质为25.0g,所以原溶液的质量分数为25%,代入可知浓度为c=
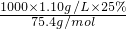 =3.7mol?L-1,两烧杯中剩余溶液均为饱和溶液,质量分数相等.
=3.7mol?L-1,两烧杯中剩余溶液均为饱和溶液,质量分数相等.解答:A.设原100gKCl溶液中含溶质KCl的质量为xg,根据饱和溶液中的溶解度计算公式得下列关系式:
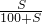 =
= =
=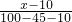 ,解得x=25 g,所以原KCl溶液的质量分数为
,解得x=25 g,所以原KCl溶液的质量分数为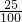 ×100%=25%,故A错误;
×100%=25%,故A错误;B.据题意得,蒸发35.0g水析出KCl固体5.0g,蒸发45.0g水析出KCl固体10.0g,推断出蒸发10.0g水析出KCl固体5.0 g,故100g水中溶有50g KCl固体得到饱和溶液,即KCl的溶解度为50g,故B正确;
C.原溶液的质量分数为25%,代入可知浓度为c=
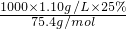 =3.7mol?L-1,故C错误;
=3.7mol?L-1,故C错误;D.甲、乙烧杯中蒸发水后均有KCl固体析出,说明均已达到饱和,此时质量分数相伺,故D错误.
故选B.
点评:本题考查溶解度的有关问题,考查学生的思维能力,题目难度中等,注意根据根据溶液和溶质质量变化计算溶液的质量分数和溶解度为解答该题的关键.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升.若用同样的铝片投入同浓度的硫酸
铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______.(填序号)
A.生成氯化铝溶于水,而生成硫酸铝不溶于水
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
(2)铝片表面出现的暗红色物质是______.
(3)放出的气体是______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的其中一种原因是______.
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是______.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在 X 电解质溶液中构成原电池,列表如下:
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.