��Ŀ����
��������������п�̸ɵ�صĻ���ԭ�ϣ���ͨп�̸ɵ�صĵ�ط�ӦʽΪ��
2MnO2+Zn+2H2O=2MnOOH+Zn��OH��2����ҵ�������̿�Ϊԭ�ϣ��������������Ʊ��ߴ��ȶ������̵��������£����̿������н���Ԫ�������������¾�����������ʽ���ڣ���
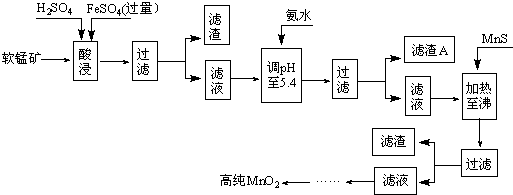
ij���̿����Ҫ�ɷ�ΪMnO2������Si��16.27%����Fe��5.86%����Al��3.24%����Zn��2.68%����Cu��0.86%����Ԫ�صĻ��������������������������ʽ��ȫ����ʱ����Һ��pH�����������Ksp����Ϊ25��ʱ�����±����ش��������⣺
| ������ | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Mn��OH��2 | Cu��OH��2 | Zn��OH��2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| ������ | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5��10-45 | 1.2��10-23 | 1.4��10-15 | 3.7��10-14 |
��2������A����Ҫ�ɷ�Ϊ______����3������MnS��Ŀ���dz�ȥ______���ʣ�
��4������п�̵���У�MnO2����ĵ缫��ӦʽΪ______��
��5���ӷϾɼ���п�̵���пɻ������õ�������______��д���֣�
�ʴ�Ϊ��2FeSO4+MnO2+2H2SO4=MnSO4+Fe2��SO4��3+2H2O��
��2�������Ĺ���Һ�к���Mn2+��Fe3+��Al3+��Cu2+��Zn2+��Fe2+���Ӱ�ˮ��pH��5.4���������������������������ʽ��ȫ����ʱ��Һ��pH��֪��Fe3+��Al3+��ȫת��ΪFe��OH��3��Al��OH��3�������������Ӳ�������������A����Ҫ�ɷ�Ϊ
Fe��OH��3��Al��OH��3��
�ʴ�Ϊ��Fe��OH��3��Al��OH��3��
��3���������������Ksp��֪������MnS��Ϊ�������ܽ�ȸ�С��CuS��ZnS����ȥCu2+��Zn2+��
�ʴ�Ϊ��Cu2+��Zn2+��
��4������п�̸ɵ����Zn����������MnO2�������õ��ӣ���缫��ӦʽӦΪMnO2+H2O+e-=MnOOH+OH-��
�ʴ�Ϊ��MnO2+H2O+e-=MnOOH+OH-��
��5���Ӽ���п�̸ɵ�ص�ԭ�Ͽ�֪����Ͼɵ�ؿɻ������õ�����Ϊп��MnO2��
�ʴ�Ϊ��п���������̣�
��������1������FeSO4�ڷ�Ӧ�����½�MnO2��ԭΪMnSO4����Fe2+������ΪFe3+�������ʱ���������̡�������������Ԫ���غ㻹��ˮ���ɣ�
��2������Ŀ��Ϣ��֪�������Ĺ���Һ�к���Mn2+��Fe3+��Al3+��Cu2+��Zn2+��Fe2+���������������������������ʽ��ȫ����ʱ��Һ��pH�����жϣ�
��3�����ݹ������̼������Ksp�жϣ�
��4���ɼ���п�̸ɵ�صĵ�ط�Ӧʽ��֪��Zn��������MnO2�õ���������������MnOOH���ɵ���غ��֪������OH-����Ԫ���غ��֪������ˮ���뷴Ӧ��
��5���Ӽ���п�̸ɵ�ص�ԭ���жϣ�
����������ѧ����Ԫ�ؼ��仯�������Ҫ���ʵ����ա���д�缫��Ӧ����ʽ���Ķ���Ŀ��ȡ����Ϣ�������Թ������̵�����ȣ��Ѷ��еȣ���Ҫѧ���߱���ʵ�Ļ������ۺ�����֪ʶ����Ϣ�����������������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�(07��㶫��)��10�֣���������������п�̸ɵ�صĻ������ϡ���ҵ�������̿�Ϊԭ�ϣ��������������Ʊ��ߴ��������̵��������£�

ij���̿����Ҫ�ɷ�ΪMnO2��������Si(16.27%)��Fe(5.86%)��Al(3.42%)��Zn(2.68%)��Cu��0.86%����Ԫ�صĻ��������������������������������ʽ��ȫ����ʱ��Һ��pH���±����ش��������⣺
������ | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ��0.42 | ��2.5 | ��7 | ��7 |
��1���������������������½�MnO2��ԭΪMnSO4�����ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ________��
��2������A����Ҫ�ɷ��� ��
��3������MnS��Ŀ���dz�ȥ ���ʡ�
��4������п�̵���У�MnO2����ĵ缫��Ӧ����ʽΪ ��
��5���ӷϾɼ���п�̵���п��Ի������õ������� ��д���֣���
��07��㶫��ѧ��24����10�֣�

��������������п�̸ɵ�صĻ������ϡ���ҵ�������̿�Ϊԭ�ϣ��������������Ʊ��ߴ��������̵��������£�
ij���̿����Ҫ�ɷ�ΪMnO2��������Si��16.72%����Fe��5.86%����Al��3.42%����Zn��2.68%����Cu��0.86%����Ԫ�صĻ��������������������������������ʽ��ȫ����ʱ��Һ��pH���±����ش��������⣺
| ������ | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | �ݨC0.42 | ��2.5 | ��7 | ��7 |
��1���������������������½�MnO2��ԭΪMnSO4�����ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ ��
��2������A����Ҫ�ɷ��� ��
��3������MnS��Ŀ���dz�ȥ ���ʡ�
��4������п�̵���У�MnO2����ĵ缫��Ӧ����ʽΪ ��
��5���ӷϾɼ���п�̵���п��Ի������õ������� ��д�����֣���
��10�֣���������������п�̸ɵ�صĻ���ԭ�ϣ���ͨп�̸ɵ�صĵ�ط�ӦʽΪ��2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2����ҵ�������̿�Ϊԭ�ϣ��������������Ʊ��ߴ��ȶ������̵��������£����̿������н���Ԫ�������������¾�����������ʽ���ڣ���

ij���̿����Ҫ�ɷ�ΪMnO2������Si��16.27%����Fe��5.86%����Al��3.24%����Zn��2.68%����Cu��0.86%����Ԫ�صĻ��������������������������ʽ��ȫ����ʱ����Һ��pH�����������Ksp����Ϊ25��ʱ�����±����ش��������⣺
|
������ |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
|
������ |
CuS |
ZnS |
MnS |
FeS |
|
|
|
Ksp |
8.5��10��45 |
1.2��10��23 |
1.4��10��15 |
3.7��10��14 |
|
|
��1���������������������½�MnO2��ԭΪMnSO4�����ʱ��������Ҫ���ӷ���ʽΪ��
��
��2������A����Ҫ�ɷ�Ϊ ��
��3������MnS��Ŀ���dz�ȥ ���ʡ�
��4������п�̵���У�MnO2����ĵ缫��ӦʽΪ ��
��5���ӷϾɼ���п�̵���пɻ������õ������� ��д���֣���

