题目内容
6.天然气的主要成分是甲烷,甲烷是一种重要的燃料和基础化工原料.以甲烷和水为原料可制取甲醇.①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ/mol
②CO(g)+2H2(g)?CH3OH(g)△H=-129.0kJ/mol
则CH4(g)+H2O(g)?CH3OH(g)+H2(g)的△H=+77.0kJ/mol.
分析 依据盖斯定律,目标反应为①-②,以此计算的反应热.
解答 解:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0kJ•mol-1
②CO(g)+2H2(g)═CH3OH(g)△H=-129.0kJ•mol-1
依据盖斯定律,①-②得:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+206.0kJ/mol-(-129.0kJ/mol)=+77.0 kJ/mol;
故答案为:+77.0.
点评 本题考查了盖斯定律的应用,熟悉热化学方程式书写的方法及盖斯定律计算反应热的方法,题目难度较大.

练习册系列答案
相关题目
16.下列物质不属于同素异形体的是( )
| A. | 金刚石和石墨 | B. | 水晶和石英 | C. | 红磷和白磷 | D. | C60和金刚石 |
17.下列说法正确的是( )
①氘和氚是质量数不同、质子数相同的氢的两种元素
②氢元素是指1H
③1H、2H、3H是氢的三种同位素,是同一种元素的三种原子
④1H和2H的化学性质几乎完全相同
⑤H2、D2、T2的摩尔质量相等.
①氘和氚是质量数不同、质子数相同的氢的两种元素
②氢元素是指1H
③1H、2H、3H是氢的三种同位素,是同一种元素的三种原子
④1H和2H的化学性质几乎完全相同
⑤H2、D2、T2的摩尔质量相等.
| A. | ②③ | B. | ③④ | C. | ①③④⑤ | D. | ②③④⑤ |
14.下列说法正确的是( )
| A. | H、D、T表示三种氢原子 | |
| B. | 卤族元素最高化合价均为正7价,最低化合价均为负1价 | |
| C. | 金属元素的原子最外层电子数,都少于4个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
1.如图为Zn、铜水果电池装置示意图,下列说法正确的是( )
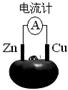

| A. | 铜片为负极,发生还原反应 | B. | 锌片上发生还原反应:Zn-2e-=Zn2+ | ||
| C. | 该装置将电能转变为化学能 | D. | 电子由锌片沿导线流向铜极 |
18.下列有关晶胞的叙述正确的是( )
| A. | 晶胞是晶体中最小的结构基本单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都完全属于该晶胞 | |
| D. | 晶胞都是正方体 |
2.下列各组物质中属于同分异构体的是( )
| A. | 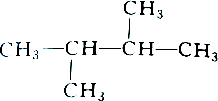 和 和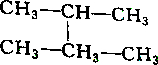 | B. | 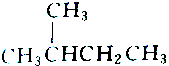 和 和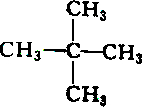 | ||
| C. | 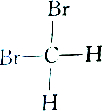 和 和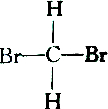 | D. | 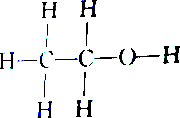 和 和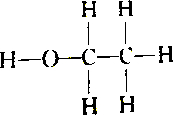 |
3.将H2S和SO2气体分别通入下列溶液中,只有一种气体反应是( )
| A. | 溴水 | B. | 酸性KMnO4 | C. | 浓HNO3 | D. | CuSO4溶液 |