题目内容
3.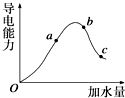 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:(1)冰醋酸在O点时是否导电否(填是或否),理由是共价化合物在固态时不导电.
(2)H+的物质的量最大的是c(填“a”、“b”或“c”).
(3)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的ACEF(填序号).
A.加热 B.加很稀的NaOH溶液 C.加NaOH固体
D.加水 E.加固体CH3COONa F.加入锌粒.
分析 (1)含有自由移动离子或电子的物质能导电;
(2)醋酸是弱电解质,随着醋酸的稀释,醋酸电离程度越大,离子导电能力与离子浓度成正比;
(3)若使c点溶液中的c(CH3COO-)增大,可以采用升高温度、加入含有醋酸根离子的可能性盐、加入固体碱或加入和氢离子反应的固体物质.
解答 解:(1)醋酸是共价化合物,冰醋酸中没有自由移动电子,不能导电,故答案为:否;共价化合物在固态时不导电;
(2)醋酸是弱电解质,随着醋酸的稀释,醋酸电离程度越大,根据图片知,醋酸电离程度最大的是c点,则c点氢离子的物质的量最大,但氢离子浓度最大的是b,故选c;
(3)若使c点溶液中的c(CH3COO-)增大,可以采用升高温度、加入含有醋酸根离子的可能性盐、加入固体碱或加入和氢离子反应的固体物质.
(3)A.醋酸是弱电解质,电离时需要吸收热量,所以加热促进醋酸电离,导致醋酸根离子浓度最大,故正确;
B.加很稀的NaOH溶液,促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,故错误;
C.加NaOH固体,NaOH和醋酸发生中和反应生成醋酸钠,促进醋酸电离,溶液体积不变,醋酸根离子浓度增大,故正确;
D.加水促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,故错误;
E.加固体CH3COONa,醋酸钠电离出醋酸根离子导致醋酸根离子浓度增大,故正确;
F.加入锌粒,锌和氢离子发生置换反应而促进醋酸电离,则醋酸根离子浓度增大,故正确;
故选ACEF.
点评 本题考查弱电解质的电离,明确弱电解质电离影响因素是解本题关键,知道溶液导电能力与离子浓度成正比,与电解质强弱无关.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
13.下列物质中所含原子数按从多到少的顺序排列正确的是( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃时18mL水 ④0.8mol H3PO4.
①0.5mol NH3 ②标准状况下22.4L He ③4℃时18mL水 ④0.8mol H3PO4.
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ④③①② |
14.能与SO2气体起反应,但无沉淀产生的是( )
①溴水 ②Ba(OH)2溶液 ③石灰水 ④Na2CO3 ⑤稀H2SO4 ⑥Na2SO3.
①溴水 ②Ba(OH)2溶液 ③石灰水 ④Na2CO3 ⑤稀H2SO4 ⑥Na2SO3.
| A. | 只有① | B. | ①③④ | C. | ①④⑥ | D. | ④⑤⑥ |
18.将5mol/L MgCl2溶液a mL稀释至b mL,稀释后溶液中Cl-的物质的量浓度为( )
| A. | $\frac{5a}{b}$ mol/L | B. | $\frac{10a}{b}$ mol/L | C. | $\frac{b}{5a}$ mol/L | D. | $\frac{a}{b}$ mol/L |
8.下列说法正确的是( )
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热决定于生成物具有的总能量和反应物具有的总能量的大小
⑤反应物的总能量高于生成物的总能量时,发生放热反应
⑥反应物的总能量低于生成物的总能量时,发生吸热反应
⑦化学反应中的能量变化都表现为热量的变化.
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热决定于生成物具有的总能量和反应物具有的总能量的大小
⑤反应物的总能量高于生成物的总能量时,发生放热反应
⑥反应物的总能量低于生成物的总能量时,发生吸热反应
⑦化学反应中的能量变化都表现为热量的变化.
| A. | ①②③④⑤⑥ | B. | ②③ | C. | ②③⑦ | D. | ①④⑤⑥ |
15.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Mg2+、MnO4-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | K+、Na+、AlO2-、NO3- | D. | Mg2+、K+、HCO3-、OH- |
12.下面用轨道表示式表示原子的价电子排布正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
13.对于CCl2F2(商品名称是氟利昂-12),下列有关叙述正确的是( )
| A. | 有两种同分异构体 | B. | 是非极性分子 | ||
| C. | 只有一种结构,无同分异构体 | D. | 是一种制冷剂 |