题目内容
在硫酸铝、硫酸钾和明矾[KAl(SO4)2?12H2O]的混合溶液100ml中,SO42-的浓度为0.9mol/L,当加入2mol/L KOH溶液100ml时,生成的沉淀恰好完全溶解.则原混合物中K+的物质的量浓度是________.
0.3mol/l
分析:混合溶液中加入2mol/L KOH溶液100ml时沉淀完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,根据n=cV计算氢氧化钠的物质的量,进而计算原溶液中Al3+的物质的量,根据c= 计算原溶液中Al3+的浓度,根据溶液出电中性,故原溶液中有c(K+)+3c(Al3+)=2c(SO42-),据此计算.
计算原溶液中Al3+的浓度,根据溶液出电中性,故原溶液中有c(K+)+3c(Al3+)=2c(SO42-),据此计算.
解答:原混合溶液中加入2mol/L KOH溶液100ml时沉淀完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,加入氢氧化钠的物质的量为2mol/L×0.1mol=0.2L,由Al3++4OH-=AlO2-+2H2O可知,原溶液中Al3+的物质的量为0.2mol×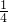 =0.05mol,故原溶液中Al3+的浓度为
=0.05mol,故原溶液中Al3+的浓度为 =0.5mol/L,根据溶液出电中性,故原溶液中有c(K+)+3c(Al3+)=2c(SO42-),所以c(K+)+3×0.5mol/L=2×0.9mol/L,解得:c(K+)=0.3mol/L,
=0.5mol/L,根据溶液出电中性,故原溶液中有c(K+)+3c(Al3+)=2c(SO42-),所以c(K+)+3×0.5mol/L=2×0.9mol/L,解得:c(K+)=0.3mol/L,
故答案为:0.3mol/L.
点评:本题考查物质的量浓度的有关计算、反应方程式的计算,难度中等,确定原溶液中铝离子的浓度是解题的关键,注意电解质混合溶液中根据电荷守恒计算离子浓度,
分析:混合溶液中加入2mol/L KOH溶液100ml时沉淀完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,根据n=cV计算氢氧化钠的物质的量,进而计算原溶液中Al3+的物质的量,根据c=
 计算原溶液中Al3+的浓度,根据溶液出电中性,故原溶液中有c(K+)+3c(Al3+)=2c(SO42-),据此计算.
计算原溶液中Al3+的浓度,根据溶液出电中性,故原溶液中有c(K+)+3c(Al3+)=2c(SO42-),据此计算.解答:原混合溶液中加入2mol/L KOH溶液100ml时沉淀完全溶解,发生反应Al3++4OH-=AlO2-+2H2O,加入氢氧化钠的物质的量为2mol/L×0.1mol=0.2L,由Al3++4OH-=AlO2-+2H2O可知,原溶液中Al3+的物质的量为0.2mol×
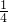 =0.05mol,故原溶液中Al3+的浓度为
=0.05mol,故原溶液中Al3+的浓度为 =0.5mol/L,根据溶液出电中性,故原溶液中有c(K+)+3c(Al3+)=2c(SO42-),所以c(K+)+3×0.5mol/L=2×0.9mol/L,解得:c(K+)=0.3mol/L,
=0.5mol/L,根据溶液出电中性,故原溶液中有c(K+)+3c(Al3+)=2c(SO42-),所以c(K+)+3×0.5mol/L=2×0.9mol/L,解得:c(K+)=0.3mol/L,故答案为:0.3mol/L.
点评:本题考查物质的量浓度的有关计算、反应方程式的计算,难度中等,确定原溶液中铝离子的浓度是解题的关键,注意电解质混合溶液中根据电荷守恒计算离子浓度,

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
在硫酸铝、硫酸钾和明矾[KAl(SO4)2?12H2O]的混合溶液中,SO42-的浓度为0.3mol/L,当加入等体积0.4mol/LKOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
| A、0.225mol/L | B、0.25mol/L | C、0.35mol/L | D、0.7mol/L |
在硫酸铝、硫酸钾和明矾的混合溶液中,若c(SO42-)=0.2mol?L-1,当加入等体积等SO42-浓度的KOH溶液时,生成沉淀恰好溶解,则原混合物中c(K+)为( )
| A、0.2mol?L-1 | B、0.25mol?L-1 | C、0.1mol?L-1 | D、0.225mol?L-1 |