题目内容
右图中的甲、乙、丙和丁分别代表一种反应物或生成物,相互转化关系中部分反应条件略。请根据题目要求回答下列问题。
(1)若甲和乙均为含有10个电子的带电粒子,丙和丁
均为含有10个电子的分子,写出甲和乙共热时的
离子方程式 ;
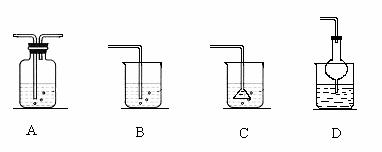
若将丙溶入丁物质中,应选择的吸收装置为 (填序号)。
(2)若甲和乙均为含有18个电子的共价化合物,丁为黄色固体,则甲的电子式为
(3)若甲是含有10个电子的化合物,乙是含有18个电子的单质分子,写出甲和乙反应的
化学方程式 ;当乙发生反应
时,转移0.1mol电子,则标况下有 L单质气体乙参加反应。
(4)若甲、乙中均含有常见金属元素,甲为单质,乙中两元素原子的质量比为21:8,则
甲、乙发生反应的化学方程式为 。
(5)若甲和丁为非金属单质,乙和丙为非金属氧化物,则甲和丁可能为 、
(列出常见的两组的名称)。
(1) NH4+ + OH- NH3 ↑+ H2O D
![]() (2)
(2)
(3)2F2 + 2H2O == 4HF + O2 1.12
(4)3Fe3O4 + 8Al 高温Al2O3 + 9Fe
(5)碳和氢气、碳和硅

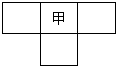 甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙).丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24.下列判断正确的是( )
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙).丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24.下列判断正确的是( )| A、元素甲的简单气态氢化物稳定性比乙的强 | B、元素乙在周期表中的位置为第2周期,VIA族 | C、元素丙和元素丁的最高价氧化物对应的水化物均为强酸 | D、4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
氨气是生产氮肥、硝酸、纯碱等的重要原料。
(1)实验室模拟合成氨。在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料(单位是mol /L),平衡时测得甲容器中H2的转化率为20%。
|
|
N2 |
H2 |
NH3 |
|
甲 |
1 |
3 |
0 |
|
乙 |
0.5 |
1.5 |
1 |
|
丙 |
0 |
0 |
4 |
①平衡时甲容器中氨气的浓度为 。
②乙容器中开始反应时,v逆 v正(填<、>或=)。
③达平衡时,甲、乙、丙三容器中NH3的体积分数由大到小的顺序为 。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g) 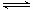 CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH_____0(填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。

③右图中的B点处,NH3的平衡转化率为 。
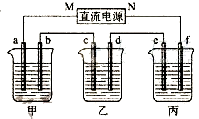 右图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
右图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
