题目内容
在一密闭的容器里装有氮气和氢气。反应开始时,氮气的浓度为2mol×L-1,氢气的浓度为5mol×L-1,反应开始2min时,测得容器中氮气的浓度为1.8 mol×L-1。这2min内氮气的平均反应速率是多少?氢气和氨气的平均反应速率各是多少?
答案:
解析:
解析:
在这两分钟内,氮气、氢气、氨气的平均反应速率分别是 0.1mol×L-1×min-1、0.3mol×L-1×min-1、0.2mol×L-1×min-1 N2 + 3H2ƒ2NH3 起始浓度/mol×L-1 2 5 0 两分钟后浓度/mol×L-1 1.8 4.4 0.4 变化浓度/mol×L-1 0.2 0.6 0.4 用氮气浓度变化表示的反应速率是: v(N 用氢气和氨气浓度变化表示的反应速率分别是: v(H v(NH
|

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
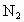 和
和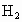 .反应开始时,
.反应开始时,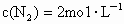 ,
,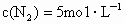 .反应开始2min时,测得容器中
.反应开始2min时,测得容器中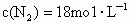 .求这2min内
.求这2min内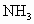 的平均反应速率各是______
的平均反应速率各是______ 和
和 .反应开始时,
.反应开始时, ,
, .反应开始2min时,测得容器中
.反应开始2min时,测得容器中 .求这2min内
.求这2min内 的平均反应速率各是______
的平均反应速率各是______