题目内容
【题目】Ⅰ.工业合成氨反应在生产中具有重要意义,完成下列问题:
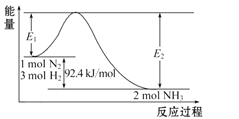
(1)写出合成氨反应的热化学方程式:____。
(2)在甲乙两个体积均为 2L 固定容积的密闭容器中,分别充入甲:1molN2、3molH2 和乙:2molN2、6molH2(其它条件相同),经过足够长的时间后,在乙容器中放出热量_____________ (填“大于”、 “小于”或“等于”)在甲容器中放出热量的 2 倍。
(3)下列图像分别代表焓变(△H)、混合气体平均相对分子质量(![]() )、N2 体积分数 φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是_____________ 。
)、N2 体积分数 φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是_____________ 。
A. 
B. 
C. 
D. 
Ⅱ.常温下,有浓度均为 0.1 mol·L-1 的下列 4 种溶液:①H2SO4 溶液②CH3COOH 溶液③Na2CO3 溶液④NaOH 溶液
(1)以上 4 种溶液 pH 由大到小的排列顺序是______________(填序号),其中由水电离出的H+浓度最小的是____________ (填序号)。
(2)③溶液中离子浓度由大到小的顺序____________。
(3)该温度下向②中加入少量 CH3COONa,此时![]() 的值____________(填“增大”、“减小”或“不变”)。
的值____________(填“增大”、“减小”或“不变”)。
【答案】N2(g)+3H2(g)2NH3(g) △H=92.4kJ/mol 大于 BC ④③②① ① c(Na+)>c(CO32—)>c(OH—)>c(HCO3—)>c(H+)
【解析】
Ⅰ.(1) △H=反应物的活化能生成物的活化能,92.4KJ/mol=E1E2,该热化学方程式为N2(g)+3H2(g)2NH3(g) △H=92.4kJ/mol;
(2) 在甲乙两个体积均为 2L 固定容积的密闭容器中,分别充入甲:1molN2、3molH2 和乙:2molN2、6molH2(其它条件相同),等效平衡是给甲容器加压;
(3) A.对与固定的反应焓变是固定不变的,与平衡状态无关,故A错误;
B. 随着反应的进行,气体物质的量减小,气体的质量不变,则混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不变时即是平衡状态,故B正确;
C. 随着反应的进行,N2体积分数Φ(N2)逐渐减小,当Φ(N2)不变时即是平衡状态,故C正确;
D. 容器的体积不变,气体的质量守恒,则混合气体的密度始终不变,所以混合气体的密度不变时,不一定是平衡状态,故D错误;
Ⅱ.(1)硫酸是二元强酸,溶液显强酸性;醋酸是弱酸;碳酸钠溶液中CO32-的水解程度强于H2CO3的电离程度,溶液显弱碱性;氢氧化钠是强碱,溶于水显强碱性;水是弱电解质,存在电离平衡H2O![]() H++OH-。因此酸电离出的氢离子浓度或碱电离出的OH-浓度越大,对水的电离抑制程度越大;
H++OH-。因此酸电离出的氢离子浓度或碱电离出的OH-浓度越大,对水的电离抑制程度越大;
(2)由于碳酸钠溶液中CO32-的水解程度强于H2CO3的电离程度,溶液显碱性;
(3)CH3COOH溶液中存在电离平衡CH3COOH ![]() CH3COO-+H+,加入CH3COONa固体,c(CH3COO-)增大,平衡左移,c(H+)减小;CH3COOH的电离平衡常数K=
CH3COO-+H+,加入CH3COONa固体,c(CH3COO-)增大,平衡左移,c(H+)减小;CH3COOH的电离平衡常数K= 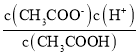 ,温度不变,电离平衡常数不变;
,温度不变,电离平衡常数不变;
Ⅰ.(1) △H=反应物的活化能生成物的活化能,92.4KJ/mol=E1E2,该热化学方程式为N2(g)+3H2(g)2NH3(g) △H=92.4kJ/mol;故答案为:N2(g)+3H2(g)2NH3(g) △H=92.4kJ/mol;
(2) 在甲乙两个体积均为 2L 固定容积的密闭容器中,分别充入甲:1molN2、3molH2 和乙:2molN2、6molH2(其它条件相同),等效平衡是给甲容器加压,合成氨是气体体积减小的反应,增大压强反应正向移动,放出更多的热量,在乙容器中放出热量大于在甲容器中放出热量的 2 倍;
(3) A.对与固定的反应焓变是固定不变的,与平衡状态无关,故A错误;
B. 随着反应的进行,气体物质的量减小,气体的质量不变,则混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不变时即是平衡状态,故B正确;
C. 随着反应的进行,N2体积分数Φ(N2)逐渐减小,当Φ(N2)不变时即是平衡状态,故C正确;
D. 容器的体积不变,气体的质量守恒,则混合气体的密度始终不变,所以混合气体的密度不变时,不一定是平衡状态,故D错误;
故答案为:BC。
Ⅱ.(1)硫酸是二元强酸,溶液显强酸性;醋酸是弱酸;碳酸钠溶液中CO32-的水解程度强于H2CO3的电离程度,溶液显弱碱性;氢氧化钠是强碱,溶于水显强碱性,所以这4种溶液pH由大到小的顺序是④③②①;水是弱电解质,存在电离平衡H2O![]() H++OH-。因此酸电离出的氢离子浓度或碱电离出的OH-浓度越大,对水的电离抑制程度越大。硫酸中氢离子浓度大于氢氧化钠溶液中OH-浓度,所以硫酸溶液中由水电离的H+浓度最小,答案选①;
H++OH-。因此酸电离出的氢离子浓度或碱电离出的OH-浓度越大,对水的电离抑制程度越大。硫酸中氢离子浓度大于氢氧化钠溶液中OH-浓度,所以硫酸溶液中由水电离的H+浓度最小,答案选①;
(2)由于碳酸钠溶液中CO32-的水解程度强于H2CO3的电离程度,溶液显碱性,所以溶液中各离子浓度由大到小的顺序是c(Na+)>c(CO32—)>c(OH—)>c(HCO3—)>c(H+);
(3)CH3COOH溶液中存在电离平衡CH3COOH ![]() CH3COO-+H+,加入/span>CH3COONa固体,c(CH3COO-)增大,平衡左移,c(H+)减小;CH3COOH的电离平衡常数K=
CH3COO-+H+,加入/span>CH3COONa固体,c(CH3COO-)增大,平衡左移,c(H+)减小;CH3COOH的电离平衡常数K= 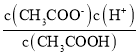 ,温度不变,电离平衡常数不变,故
,温度不变,电离平衡常数不变,故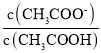 变大,
变大,![]() 的值变小,故答案为:变小;
的值变小,故答案为:变小;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知 1g 氢气完全燃烧生成液态水时放出热量 143kJ,18g 水蒸气变成液态水放出 44kJ 的热量。其他相关数据如下表:则表中 x 为( )
O=O | H-H | H-O(g) | |
1mol 化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
A.920B.557C.463D.188
【题目】![]() 俗称海波
俗称海波![]() 是常用的一种定影剂。工业使用的海波中常混有少量
是常用的一种定影剂。工业使用的海波中常混有少量![]() 和
和![]() 的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀硫酸20mL,充分反应后测得有关实验数据如下
的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀硫酸20mL,充分反应后测得有关实验数据如下![]() 标准状况
标准状况![]() 。
。
第一份 | 第二份 | 第三份 | |
样品的质量 |
|
|
|
二氧化硫的体积 |
|
|
|
硫的质量 |
|
|
|
下列说法错误的是 ![]()
![]()
A.第一份、第二份样品均完全反应,第三份样品过量
B.样品中![]() :
:![]() :1
:1
C.样品中除了含有![]() 、
、![]() ,还含有
,还含有![]()
D.所加硫酸溶液的物质的量浓度为![]()
【题目】HClO4、H2SO4、HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋酸中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4![]() 2H++
2H++![]()
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
