题目内容
15. 已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中不正确的是( )
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中不正确的是( )| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应热△H=+(a-b) kJ•mol-1 | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 分别断裂1 molA2和1 molB2中的化学键,共吸收a kJ能量 |
分析 由图可知,A2(g)+B2(g)═2AB(g)中反应物的总能量小于生成物的总能量,则为吸热反应,焓变等于正逆反应的活化能之差,以此来解答.
解答 解:A.化学计量数不表示分子个数,只表示物质的量,故A错误;
B.焓变等于正逆反应的活化能之差,则△H=+(a-b) kJ•mol-1,故B正确;
C.为吸热反应,反应物的总能量低于生成物的总能量,故C正确;
D.断键吸收能量,则断裂1 molA2和1 molB2中的化学键,共吸收a kJ能量,故D正确;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化、焓变与活化能的关系为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
5.下列关于有机物的说法正确的是( )
| A. | 天然气为纯净物 | |
| B. | 天然气是不可再生的能源 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 过量的CH4和Cl2在光照条件下反应只生成CH3Cl |
6.下列物质能通过化合反应直接制得的是( )
①FeCl2 ②Fe(OH)3 ③NH4NO3 ④HCl.
①FeCl2 ②Fe(OH)3 ③NH4NO3 ④HCl.
| A. | 只有①②③ | B. | 只有②③ | C. | 只有①③④ | D. | 全部 |
3.X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
| A. | X:3s23p1 Y:3s23p4 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p5 | D. | X:2s22p3 Y:1s1 |
10.已知有A、B、C、D、E五种短周期元素,其原子序数依次增大,A与B形成的共价化合物的水溶液呈碱性,C元素原子的最内层电子数是最外层电子数的2倍,D是同周期中单核离子半径最小的元素,E元素的最高正价与最低负价的代数和为6.下列叙述中错误的是( )
| A. | B元素的简单气态氢化物与E的氢化物化合,生成物的水溶液呈酸性 | |
| B. | B、C、E最高价氧化物对应的水化物溶液均能与D元素的氧化物反应 | |
| C. | 元素B、E分别与元素A构成的含有18个电子的分子中均含有非极性共价键 | |
| D. | 最高价氧化物对应水化物的碱性:C>D |
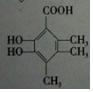
20.下列三种有机物是某些药物中的有效成分:

以下说法正确的是( )

以下说法正确的是( )
| A. | 将各1mol的三种物质分别与氢氧化钠溶液充分反应,阿司匹林消耗氢氧化钠最多 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种有机物中的所有原子不可能共平面 | |
| D. | 三种有机物都能与浓溴水发生反应 |
18. 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | M-空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高 |
2.我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱.以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置.装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水

四种盐在不同温度下的溶解度(g/100g水)表
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是CADB(填字母).
(2)A装置中盛放的试剂是饱和NaHCO3溶液,其作用是除去CO2中的HCl.
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是温度超过35℃,碳酸氢铵开始分解,温度太低,反应速率降低,不利于反应进行.
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体.用蒸馏水洗涤NaHCO3晶体的目的是除去NaCl、NH4C1、NH4HCO3杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有NaHCO3、NaCl、NH4C1、NH4HCO3(以化学式表示),加入氯化氢,并进行结晶操作,使NaCl溶液循环使用,同时可回收NH4C1.

四种盐在不同温度下的溶解度(g/100g水)表
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
请回答以下问题:
(1)装置的连接顺序应是CADB(填字母).
(2)A装置中盛放的试剂是饱和NaHCO3溶液,其作用是除去CO2中的HCl.
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是温度超过35℃,碳酸氢铵开始分解,温度太低,反应速率降低,不利于反应进行.
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体.用蒸馏水洗涤NaHCO3晶体的目的是除去NaCl、NH4C1、NH4HCO3杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有NaHCO3、NaCl、NH4C1、NH4HCO3(以化学式表示),加入氯化氢,并进行结晶操作,使NaCl溶液循环使用,同时可回收NH4C1.

 .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 .
. .
.