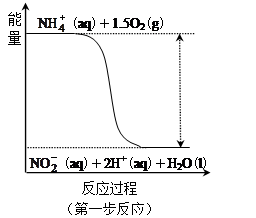题目内容
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。则下列说法错误的是
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1:2 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.若反应中转移的电子数目为6.02×1023,则可生成22.4L NO气体(标准状况) |
| D.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
B
解析试题分析:NF3中N为+3价,F为-1价,故与水发生的是歧化反应,配平后有3NF3+5H2O=9HF+2NO+HNO3,B、泄露后与空气中水蒸气反应,产生HF白雾,NO氧化生成NO2有红棕色气体,故错误。
考点:氧化还原反应

练习册系列答案
相关题目
同位素示踪法可用于反应机理的研究,下列有关反应中同位素示踪表示正确的是
| A.2Na218O2 + 2H2O=4Nal8OH + O2↑ |
| B.2KMnO4 + 5H218O2 + 3H2SO4=K2SO4 + 2MnSO4 + 518O2↑ + 8H2O |
C.NH4Cl + 2H2O NH3·2H2O + HCl NH3·2H2O + HCl |
| D.K37ClO3 + 6HCl=K37Cl + 3Cl2↑ + 3H2O |
下列反应中,水作为氧化剂的是
| A.SO2与H2O反应 | B.Al与NaOH溶液反应 |
| C.NO2与H2O反应 | D.Na2O2与H2O反应 |
氢化铝钠(NaAlH4)是最冇研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4 Na3AlH6+2Al+3H2↑。下列说法正确的是
Na3AlH6+2Al+3H2↑。下列说法正确的是
| A.NaAlH4中氢元素为+1价 |
| B.每生成11. 2 L(标准状况下)H2,转移2NA个电子 |
| C.在反应中有50%的氢被氧化 |
| D.反应中氧化产物与还原产物的物质的量之比为1: 1 |
在Cu2S+2Cu2O 6Cu+SO2↑反应中,说法正确的是
6Cu+SO2↑反应中,说法正确的是
| A.Cu2O在反应中被氧化 | B.Cu2S在反应中既是氧化剂又是还原剂 |
| C.Cu既是氧化产物又是还原产物 | D.若反应中转移12mol电子,则生成6molCu |
已知:①向盛有稀H2SO4试管中加入Fe粉,Fe粉完全溶解得浅绿色溶液;
②向实验①浅绿色溶液中滴加NaOH溶液,生成白色沉淀并立即变为红褐色;
③向实验②红褐色沉淀中滴加溶有淀粉的HI溶液,红褐色沉淀溶解得蓝色溶液。
下列判断正确的是
| A.上述实验中,共涉及四个氧化还原反应 |
| B.实验可证明还原性:H+>Fe2+>OH->I- |
| C.实验②可证明溶解度:Fe(OH)3>Fe(OH)2 |
| D.实验③中,反应的离子方程式是:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O |
三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是( )
| A.NF3的氧化性比F2强 |
| B.NF3的还原性比NH3强 |
| C.NF3中的原子最外层均达8电子 |
| D.该反应过程转移了6 mol电子。 |
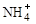 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下: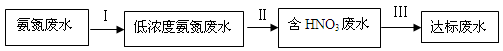
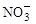 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下: