题目内容
3.在25℃的溶液温度的情况下,混合1L 0.1mol/L的氢氧化钠和1L 0.2mol/L的硝酸钙,会不会产生沉淀?为什么?分析 根据溶液饱和与否进行分析,假设完全反应生成0.05mol氢氧化钙,即3.7g,2L水的质量是2000g,$\frac{3.7g}{2000g}=\frac{{S}_{1}}{100g}$,S1=0.185g,此时S1>S.
解答 解:氢氧化钙微溶,常温下溶解度S=0.16g;
假设完全反应生成0.05mol氢氧化钙,即3.7g
2L水的质量是2000g,
$\frac{3.7g}{2000g}=\frac{{S}_{1}}{100g}$,S1=0.185g,此时S1>S,溶液过饱和,所以会产生沉淀;
答:完全反应生成0.05mol氢氧化钙,即3.7g,$\frac{3.7g}{2000g}=\frac{{S}_{1}}{100g}$,S1=0.185g,此时S1>S,溶液过饱和,所以会产生沉淀.
点评 本题考查沉淀的生成,难度不大,解题的关键是判断溶液饱和与否.

练习册系列答案
相关题目
13.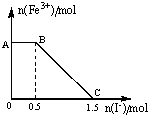 将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
 将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )| A. | 图中AB段发生的是过量的酸性KMnO4溶液与KI的反应 | |
| B. | 从题中可以得出还原性:I->Fe2+>Mn2+ | |
| C. | 取B点以后的少量溶液滴入几滴KSCN溶液,溶液变红色 | |
| D. | 根据OC段的数据可知,开始加入的KMnO4的物质的量为0.5mol |
18.X、Y、Z、W、T五种元素,其中X、Y、Z、T在周期表中的相对位置如表,X元素的单质是空气中含量最多的成分.W的单质有毒气体,常用于自来水的消毒杀菌,下列说法正确的是( )
| X | Y | |
| Z | ||
| T |
| A. | 原子半径:T>W>Z | |
| B. | 元素T与X的原子序数相差15 | |
| C. | T、Z、W三种元素的最高价氧化物对应的水化物的酸性依次减弱 | |
| D. | X、W两元素的氢化物的浓溶液相互靠近时有白烟产生 |
15.NA为阿伏加德罗常数的值,下列说法一定正确的是( )
| A. | 1 L 1 mol•L-1的醋酸溶液中含有的醋酸分子数为NA | |
| B. | 电解精炼铜时,当阳极上质量减少6.4 g时,电路中转移的电子数为2NA | |
| C. | 常温下,46 g NO2和N2O4的混合物中含有的氧原子数为2NA | |
| D. | 11.2 L CO2中含有的分子数为0.5NA |
12.关于下列图示的说法中正确的是( )
| A. |  用图1装置除去HCl中少量的Cl2 | |
| B. |  用图2装置蒸干Al2(SO4)3饱和溶液制取无水Al2(SO4)3 | |
| C. |  图3制备并收集少量NO2 | |
| D. |  图4是原电池装置,Fe电极为阴极 |
 $\stackrel{△}{→}$
$\stackrel{△}{→}$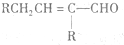 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸 合成兔耳草醛的路线如下:
合成兔耳草醛的路线如下:
 、
、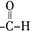 (写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热
(写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热 .
. 、
、 .
.