题目内容
下列说法正确的是( )
| A、盐溶液都是中性的 |
| B、盐溶液的酸碱性与盐的类型无关 |
| C、NaHCO3溶液显酸性 |
| D、Na2CO3溶液显碱性,是因为溶液中c(OH-)>c(H+) |
考点:盐类水解的应用
专题:盐类的水解专题
分析:A、能水解的盐溶液不一定是中性的;
B、盐溶液的酸碱性与盐的类型有关;
C、NaHCO3溶液中碳酸氢根离子会发生水解反应;
D、当氢氧根离子浓度大于氢离子浓度时,溶液会显示碱性.
B、盐溶液的酸碱性与盐的类型有关;
C、NaHCO3溶液中碳酸氢根离子会发生水解反应;
D、当氢氧根离子浓度大于氢离子浓度时,溶液会显示碱性.
解答:
解:A、能水解的盐溶液不是中性的,有的显示酸性,有的显示碱性,故A正确;
B、盐溶液的酸碱性与盐的类型有关,强酸强碱盐显示中性,强酸弱碱盐显示酸性,强碱弱酸盐显示碱性,故B错误;
C、NaHCO3溶液中碳酸氢根离子会发生水解反应,溶液显示碱性,故C错误;
D、Na2CO3溶液显碱性,是因为碳酸根离子水解,导致溶液中氢氧根离子浓度大于氢离子浓度,故D正确.
故选D.
B、盐溶液的酸碱性与盐的类型有关,强酸强碱盐显示中性,强酸弱碱盐显示酸性,强碱弱酸盐显示碱性,故B错误;
C、NaHCO3溶液中碳酸氢根离子会发生水解反应,溶液显示碱性,故C错误;
D、Na2CO3溶液显碱性,是因为碳酸根离子水解,导致溶液中氢氧根离子浓度大于氢离子浓度,故D正确.
故选D.
点评:本题考查学生盐的水解规律以及盐的水解原理的应用知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
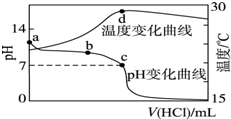 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、a点由水电离出的c(H+)<1.0×10-14mol/L |
| B、b点:n(NH4+)+n(NH3?H2O)>n(Cl-) |
| C、b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL |
| D、d点后,温度略下降的主要原因是生成的NH4Cl水解吸热 |
将4g NaOH溶解配成10mL溶液,再稀释成1L,从中取出10mL,则这10mL溶液的物质的量浓度是( )
| A、1mol/L |
| B、0.1 mol/L |
| C、0.01mol/L |
| D、10mol/L |
钠氯化镍蓄电池是一种新型的电动汽车蓄电池,其正极MCl2中的M代表Ni、Fe、Ca、Cr、Mn、Cu等一系列金属,其中NiCl2的效果最好.而负极的活性物质是液态金属钠.正、负极活性物质被一种只允许Na+迁移的β-Al2O3固体电解质陶瓷管分隔,由于正极是固态多孔金属氧化物,所以还需要添加NaAlCl4熔盐在正极处作第二电解质,在正、负极之间传导钠离子.下列有关钠氯化镍蓄电池的说法错误的是( )
| A、电池放电时的总反应为2Na+NiCl2═Ni+2NaCl |
| B、充电时阳极的电极反应为Na++e-═Na |
| C、放电时正极的电极反应为Ni2++2e-═Ni |
| D、该电池被称为绿色电池,最大原因是从废弃电池中可以方便地回收较纯的镍,其他产物对环境没有影响 |
下列实验设计和结论相符的是( )
| A、可以利用过滤的方法分离胶体和溶液 |
| B、用过量氨水除去Fe3+溶液中的少量Al3+ |
| C、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| D、镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 |
现有44g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与1L含有一定质量的20%硫酸溶液恰好完全反应,得到无水盐140g,则下列说法正确的是( )
| A、电子转移为1mol |
| B、生成的气体体积(标准状况)为22.4 L |
| C、硫酸溶液的质量为540g |
| D、硫酸物质的量浓度为2mol/L |
下列各组物质中一定属于同系物的是( )
| A、CH4和C2H4 |
| B、烷烃和环烷烃 |
| C、C2H4和C4H8 |
| D、C5H12和C2H6 |
以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10,现用0.1000mol/LNaOH溶液滴定浓度相近的醋酸时,上述指示剂( )
| A、都可以用 |
| B、只能用③ |
| C、可以用①或② |
| D、可以用②或③ |
下列的排序不正确的是( )
| A、晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B、沸点由高到低:Na>Mg>Al |
| C、硬度由大到小:金刚石>SiC>晶体硅 |
| D、晶格能由大到小:MgF2>NaCl>NaBr |