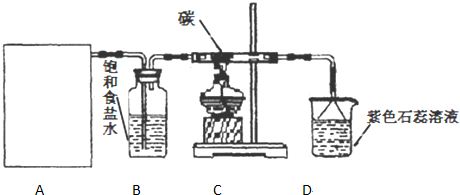
题目内容
17.运用元素周期律分析下面推断,其中错误的是( )| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
分析 A、元素周期表中的对角线规则:处于对角线的元素具有相似性;
B、同主族元素性质具有相似性;
C、同主族元素性质具有相似性;
D、同主族元素的原子,从上到下氢化物的稳定性逐渐减弱.
解答 解:A、元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,则BeO有两性,故A正确;
B、卤族元素性质具有相似性,根据胆汁的性质、氰化物的性质、银盐的性质可推知砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸,故B正确;
C、MgSO4、CaSO4、SrSO4溶解度依次减小,可以推知硫酸锶(SrSO4)是难溶于水的白色固体,故C正确;
D、同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以硒化氢(H2Se)不如H2S稳定,故D错误.
故选D.
点评 本题考查同主族元素性质具有相似性也具有一定的递变规律,注意把握元素周期律的有关知识,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16. 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )| A. | 该温度下Ag2Z的Ksp约为1×10-8 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点可表示AgI的过饱和溶液,且c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr形成的混合溶液的饱和溶液中:c(Cl-)<c(Br-) |
5.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
| A. |
| B. |
| C. |
| D. |
|
12.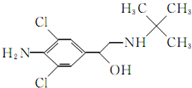 食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
 食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )| A. | 化学式为C12H18ONCl2 | |
| B. | 遇FeCl3溶液发生显色反应 | |
| C. | 属于芳香族化合物 | |
| D. | 可以发生取代、加成、水解、酯化、消去反应 |
2.下列有关环境保护的说法中不正确的是( )
| A. | 含氮、磷化合物的生活污水大量排放可使水体富营养化 | |
| B. | 各国大量排放SO2是全球气候变暖的主要原因 | |
| C. | 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 | |
| D. | 废旧电池中的汞、镉、铅等重金属对土壤和水源会造成污染 |
 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.