题目内容
17.常温下,pH=2的盐酸与pH=2的CH3COOH溶液中,大小关系不正确的是( )| A. | c(H+)相等 | B. | c(OH-)相等 | C. | c(Cl-)=c(CH3COO-) | D. | c(Cl-)<c(CH3COO-) |
分析 常温下pH=2的盐酸与pH=2的CH3COOH溶液中氢离子浓度一定相等,两溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(H+)、c(CH3COO-)+c(OH-)=c(H+),据此进行判断.
解答 解:A.常温下pH=2的溶液中氢离子浓度为0.01mol/L,两溶液中氢离子浓度相等,故A正确;
B.两溶液中氢离子浓度相等,根据水的离子积可知两溶液中氢氧根离子浓度也相等,故B正确;
C.两溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(H+)、c(CH3COO-)+c(OH-)=c(H+),由于c(H+)、c(OH-)相等,则c(Cl-)=c(CH3COO-),故C正确;
D.根据C可知c(Cl-)=c(CH3COO-),故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒的含义及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
7.下列物质的鉴别方法不正确的是( )
| A. | 用焰色反应鉴别NaCl、K2CO3 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3和NaHCO3两种溶液 |
5.FeCO3与砂糖混用可以作补血剂,实验室制备FeCO3的流程如图所示,下列说法正确的是( )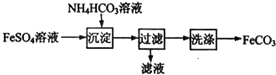

| A. | 过滤操作中所用的玻璃仪器只有烧杯和漏斗 | |
| B. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| C. | 可利用HNO3酸化的BaCl2溶液检验FeSO4溶液中的阴离子 | |
| D. | 沉淀过程中有CO2气体放出 |
2.相同状况下,4体积NO2与1.5体积O2混合通过适量水,收集到的气体体积为( )
| A. | 0.5体积 | B. | 2体积 | C. | 3体积 | D. | 4.5体积 |
2.将一定量的氯气通入50mL 10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 若反应中转移的电子数可能为$\frac{1}{3}$mol | |
| C. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为7﹕6 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕3 |
20.下列实验观察记录错误的是( )
| A. | 硫酸铝溶液中加入过量氨水,振荡,可观察到生成白色沉淀 | |
| B. | 钠在空气中加热,钠块先熔成光亮的银白色小球后燃烧,发出黄色火焰 | |
| C. | 在盛Na2O2固体的试管中先后滴入水和酚酞溶液,溶液最终呈红色 | |
| D. | 新制氯水中滴加紫色石蕊溶液先变红后褪色. |