题目内容
【题目】对于1 mol/L的NaOH溶液,下列有关说法正确的是(NA表示阿伏加德罗常数)
A. Na+的数目为NA B. OH-的物质的量为1mol
C. Na+的物质的量浓度为1mol/L D. NaOH的质量为40g
【答案】C
【解析】A.没有指明溶液体积,无法计算Na+的数目,故A错误;B.没有指明溶液体积,无法计算OH-的物质的量,故B错误;C.1 mol/L的NaOH溶液中Na+的物质的量浓度为1mol/L,故C正确;D.没有指明溶液体积,无法计算NaOH的质量,故D错误;答案为C。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】下图是实验室制备气体和验证气体性质的装置图,若利用该装置实现碳和浓硫酸的反应,并进行如下验证:

(1)实验步骤: 连接仪器、_________________、加药品后,然后滴入浓硫酸,加热。
(2)C与浓硫酸反应的化学方程式是___________________________。
(3)若要证明产物中的两种气体,装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则B、D装置中品红溶液的作用分别是________________,_________________。证明气体中有CO2的现象是____________________________。
(4)将A产生的气体通入下图装置(忽略氧气对反应的影响)进行如下探究实验。
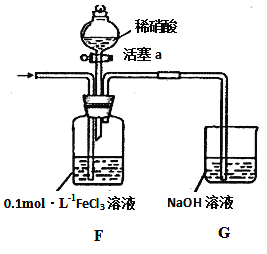
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向F装置中通入一段时间的气体. | F中溶液色溶液最终变为浅绿色 |
II | 取出少量F装置中的溶液,先加入 KSCN溶液,再加入BaCl2溶液 | 加入KSCN溶液后溶液不变色;再加入BaCl2溶液产生白色沉淀. |
III | 打开活塞a,将过量稀HNO3加入装置F中,关闭活塞a | F中浅绿色溶液最终变为黄色. |
IV | 取出少量A装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
实验II中发生反应的离子方程式是_____________________;实验III中,浅绿色溶液变为黄色的原因是___________________________________________ (用语言叙述);综合上述实验得岀的结论是:在酸性条件下,NO3﹣、Fe3+氧化性强弱顺序为_____________________

