题目内容
已知448℃时反应H2(g)+I2(g) 2HI(g)的平衡常数是49,则HI(g)
2HI(g)的平衡常数是49,则HI(g)
 H2(g)+
H2(g)+  I2(g) 在该温度下的平衡常数是
I2(g) 在该温度下的平衡常数是
A. | B.2401 | C.7 | D. |
D
解析试题分析:化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以逆反应的平衡常数是正方应平衡常数的倒数。由于逆反应的化学计量数是正方应化学计量数的 ,所以该逆反应的平衡常数K=
,所以该逆反应的平衡常数K= =
= ,答案选D。
,答案选D。
考点:考查平衡常数的计算

练习册系列答案
相关题目
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时数据如下表:
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | | |
| | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
下列事实中,不能用勒夏特列原理解释的是
| A.Fe(SCN)3,溶液中加入固体KSCN后颜色变深 |
| B.向稀盐酸中加入少量蒸馏水,盐酸中氯离子浓度降低 |
| C.实验室常用排饱和食盐水的方法收集氯气 |
| D.棕红色NO2。加压后颜色先变深后变浅 |
下列措施肯定能使化学反应速率增大的是
| A.增大反应物的量 | B.增加压强 | C.升高温度 | D.使用催化剂 |
下列各组反应(表中物质均为反应物):则反应刚开始时,放出H2的速率最大的是
| 编号 | 金属(粉末状) /mol | 酸的浓度与体积 | 反应温度 |
| A | Mg 0.1 | 6mol/L HNO3 10 mL | 60 ℃ |
| B | Mg 0.1 | 3mol/L HCl 10 mL | 60 ℃ |
| C | Fe 0.1 | 3mol/L HCl 10 mL | 60 ℃ |
| D | Mg 0.1 | 3mol/L H2SO4 10 mL | 60 ℃ |
对于可逆反应2HI(g)  I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
I2(g)+H2(g),下列叙述能够说明已达到平衡状态的是
| A.各物质的量的浓度比2 : 1 : 1 |
| B.容器内的总压不随时间变化 |
| C.断裂2 mol H-I键的同时生成1 mol I-I键 |
| D.混合气体的颜色不再变化时 |
在下列平衡2CrO42-(黄色)+ 2H+ Cr2O72-(橙红色)+ H2O中,溶液介于黄和橙红色之间,今欲增加溶液的橙红色,则要在溶液中加入
Cr2O72-(橙红色)+ H2O中,溶液介于黄和橙红色之间,今欲增加溶液的橙红色,则要在溶液中加入
| A.H+ | B.OH- | C.K+ | D.H2O |
下列事实不能用化学平衡原理解释的是
| A.温度控制在500℃有利于合成氨反应 |
| B.用排饱和食盐水法收集Cl2 |
| C.打开碳酸饮料会有大量气泡冒出 |
| D.在硫酸工业生产中使用过量的氧气 |
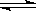 C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述不正确的是
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述不正确的是