题目内容
【题目】常温下向25mL0.1molL-1NaOH溶液中逐滴滴加0.2molL-1的一元酸HX溶液,pH的变化曲线如下图所示(溶液混合时体积的变化忽略不计).下列说法正确的是( )
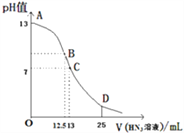
A. 在B点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(X-)
B. D点的溶液中c(H+)+c(HX)=c(X-)+c(OH-)
C. HX是弱酸,常温下其电离常数Ka=2.5×10-6
D. D点的溶液中有c(HX)-2c(H+)=2c(OH-)+c(X-)
【答案】C
【解析】B点代表加入12.5mL的HX溶液,此时恰好中和,转化为NaX的溶液,溶液显碱性,所以浓度为: c(Na+)>c(X-)>c(OH-)>c(H+),选项A错误。D点代表加入25mLHX溶液,所以溶液为HX和NaX浓度相等的混合溶液。此溶液存在电荷守恒:c(H+)+c(Na+)=c(X-)+c(OH-),选项B给出的等式为:c(H+)+c(HX)=c(X-)+c(OH-),两式子联立得到:c(HX)=c(Na+)。但是,从图中得到:D点(HX和NaX浓度相等的混合溶液)显酸性,说明HX的电离大于X-的水解,所以c(X-)>c(Na+)>c(HX),即c(HX)≠c(Na+),说明题目中的等式不成立,选项B错误。选取图中的C点数据进行运算。C点代表向25mL0.1molL-1NaOH溶液中逐滴滴加13mL的0.2molL-1的一元酸HX溶液,溶液总体积为28mL,此时溶液显中性pH=7,所以c(H+)=1×10-7mol/L;溶液中c(Na+)=0.1×![]() ,c(HX)+c(X-)=0.2×
,c(HX)+c(X-)=0.2×![]() 。因为溶液显中性,根据电荷守恒得到c(X-)= c(Na+),所以c(HX) =0.2×
。因为溶液显中性,根据电荷守恒得到c(X-)= c(Na+),所以c(HX) =0.2×![]() -0.1×
-0.1×![]() ,由上得到Ka=
,由上得到Ka= ,选项C正确。D点代表加入25mLHX溶液,所以溶液为HX和NaX浓度相等的混合溶液。此溶液存在质子守恒式:c(HX)+ 2c(H+)=2c(OH-)+c(X-),所以选项D错误。
,选项C正确。D点代表加入25mLHX溶液,所以溶液为HX和NaX浓度相等的混合溶液。此溶液存在质子守恒式:c(HX)+ 2c(H+)=2c(OH-)+c(X-),所以选项D错误。

 名校课堂系列答案
名校课堂系列答案【题目】(1)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1①
C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1②
则Fe和O2反应生成Fe2O3的热化学反应方程式为_______________________________。
(2)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①常温下NaHA溶液的pH________(填序号),原因是____________________________。
A.大于7 B.小于7 C.等于7 D.无法确定
②已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.65 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.93 | 20.00 |
请完成下列填空:
①滴定达到终点的标志是_____________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为_____________________(保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
【题目】设NA阿伏伽德罗常数的值。己知反应
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1="a" kJ/mol
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H2="b" kJ/mol,其它数据如表:
化学键 | C═O | O═O | C-H | O-H |
键能kJ·mol-1 | 798 | x | 413 | 463 |
下列说法正确的是
A. 上表中 x=(1796+b)/2
B. H2O(g)═H2O(l) △S<0,△H═(a-b )kJ/mol
C. 当有4NA个C-H键断裂时,该反应放出热量一定为a kJ
D. 利用反应(1)设计的原电池电解精炼铜时,当负极输出0.2NA个电子时,电解槽的阳极质量一定减轻6.4g