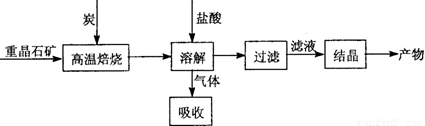
题目内容
由Na+,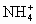 ,Ba2+,Cu2+,OH-,Fe3+,
,Ba2+,Cu2+,OH-,Fe3+,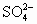 ,Cl-等八种离子中的六种两两组成的A,B,C三种化合物(它们不含有共同离子).
,Cl-等八种离子中的六种两两组成的A,B,C三种化合物(它们不含有共同离子).
(1)A,B,C均易溶于水,形成无色溶液.
(2)将A,B,C三种物质的溶液两两相互作用时,发现A与B混合后产生有刺激性气味的气体,此气体使湿润红色石蕊试纸变蓝,B与C混合产生白色沉淀.则A,B,C的分子式是:A为________;B为________;C为________;A+B的离子方程式:________;B+C的离子方程式:________.
答案:
解析:
解析:
|
A:NH4Cl或NaOH B:Ba(OH)2或(NH4)2SO4 C:Na2SO4或BaCl2 A+B: B+C:Ba2++ 导解:由(1)可除去有色离子Cu2+,Fe3+;由(2)知刺激性气味只能为NH3,是 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
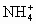 +OH-=NH3↑+H2O
+OH-=NH3↑+H2O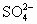 =BaSO4↓
=BaSO4↓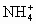 与OH-反应的结果;且沉淀只可能是由Ba2+与
与OH-反应的结果;且沉淀只可能是由Ba2+与
 4CO(g)+BaS(s)
△H1 =
+571.2kJ/mol ①
4CO(g)+BaS(s)
△H1 =
+571.2kJ/mol ①