题目内容
5. 砷化镓晶体是半导体材料,应用于太阳能电池、LED光源和通讯领域.
砷化镓晶体是半导体材料,应用于太阳能电池、LED光源和通讯领域.(1)砷元素位于元素周期表的第VA族,其原子的核外电子排布式为1s22s22p62s22p63d104s24p3.
(2)镓、砷、硒的第一电离能由大到小的顺序是砷>硒>镓,此三种元素中电负性最大的是硒.
(3)砷化镓可由(CH3)3Ga和AsH3反应制得.①常温常压下(CH3)3Ga为无色透明液体,则(CH3)3Ga固体属于分子晶体.(CH3)3Ga为非极性分子,其中镓原子的杂化轨道类型是sp2.
②AsH3的空间构型为三角锥形,中心原子的价层电子对数为4.
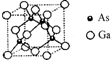
(4)砷化镓晶体的晶胞结构如图所示,晶胞的边长为acm,镓原子的配位数是4,阿伏加德罗常数值为NA,则砷化镓晶体密度的表达式为$\frac{580}{{N}_{A}×{a}^{3}}$g/cm3.
分析 (1)As原子核外电子数为33,结合能量最低原理书写核外电子排布式;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,砷原子4p能级为半满稳定状态,第一电离能高于同周期相邻元素的;同周期元素从左到右元素的电负性逐渐增强;
(3)①常温常压下(CH3)3Ga为无色透明液体,熔点低,则(CH3)3Ga固体属于分子晶体;(CH3)3Ga为非极性分子,Ga原子形成3个σ键,Ga原子最外层电子全部成键,杂化轨道数目为3;
②AsH3分子中As原子形成3个As-H键,含有1对孤对电子;
(4)根据均摊法计算晶胞中As、Ga原子数目,由图可知As原子配位数为4,结合原子数目之比计算配位数;表示出晶胞的质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)As原子核外电子数为33,核外电子排布式为:1s22s22p62s22p63d104s24p3,
故答案为:1s22s22p62s22p63d104s24p3;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,砷原子4p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:砷>硒>镓,同周期元素从左到右元素的电负性逐渐增强,则电负性:硒>砷>镓,
故答案为:砷>硒>镓;硒;
(3)①常温常压下(CH3)3Ga为无色透明液体,熔点低,则(CH3)3Ga固体属于分子晶体;(CH3)3Ga为非极性分子,Ga原子形成3个σ键,Ga原子最外层电子全部成键,杂化轨道数目为3,Ga原子采取sp2杂化,
故答案为:分子;sp2;
②AsH3分子中As原子形成3个As-H键,含有1对孤对电子,价层电子对数3+1=4,则其空间构型为三角锥形,
故答案为:三角锥形;4;
(4)晶胞中As原子数目为4、Ga原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,二者原子数目之比为1:1,由图可知As原子配位数为4,则Ga的配位数也为4,晶胞的质量为4×$\frac{70+75}{{N}_{A}}$g,则晶胞密度4×$\frac{70+75}{{N}_{A}}$g÷(a cm)3=$\frac{580}{{N}_{A}×{a}^{3}}$g/cm3,
故答案为:4;$\frac{580}{{N}_{A}×{a}^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、电负性、晶体类型与性质、空间构型与杂化方式、晶胞计算等,注意同周期第一电离能异常情况,晶胞中原子配位数之比与原子数目呈反比.

| A. | 150mL3mol/LNaCl溶液 | B. | 75mL2mol/LNaNO3溶液 | ||
| C. | 150mL2mol/LNa2SO4溶液 | D. | 75mL1mol/LNa2S |
| A. | 0.lmol/LCH3COONa溶液:c(Na+)═c(CH3COO-) | |
| B. | 0.1mol/LNa2CO3溶液:c(Na+)═c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| C. | 向醋酸钠溶液加适量醋酸所得溶液:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| D. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+) |
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 该电池反应中二氧化锰作正极,发生氧化反应 | |
| C. | 该电池工作时,电解液中的K+向锌极定向移动 | |
| D. | 电池负极的反应式为:Zn(s)-2e-+2OH-(aq)=Zn(OH)2(s) |
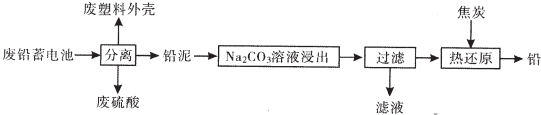
部分难溶电解质的性质如表:
| 物质 | Kap(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.8×10-20 | 白色 |
(1)在生产、生活中使用广泛,铅蓄电池的缺点有比能量低(写一条).
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→热能→机械能→电能.
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混台液经蒸发浓缩、冷却结晶等操作,可以析出十水硫酸钠晶体.
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式(CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(5)25aC时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=1.2×10-5.以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.设计实验区别PbCr04和BaCr04取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 制作快餐饭盒的可降解“玉米塑料”(主要成分是聚乳酸)是纯净物 |
| A. | 减压过滤不宜用于过滤胶状沉淀或颗粒太小的沉淀,沉淀的颗粒较大时,可用倾析法将固体与溶液分离 | |
| B. | 制备阿司匹林时,将反应物置于水浴85~90℃的锥形瓶中充分反应5~10min,冷却后,向锥形瓶中加一定量的水可以促进产物的析出 | |
| C. | 海带灼烧成灰烬后,加水煮沸2~3min并过滤,滤液中可加入适量的H2O2来氧化I- | |
| D. | 将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸,若出现白色沉淀,说明含有氯元素 |
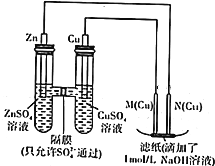 用如图示装置进行实验
用如图示装置进行实验 下列实验设计或操作合理的是BGH
下列实验设计或操作合理的是BGH