题目内容
下列图示与对应的叙述相符的是( )
A、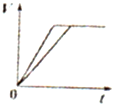 表示物质的量之比为2:3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系 | B、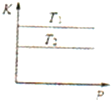 表示2SO2(g)+O2(g)?2SO3(g)(△H<0)的平衡常数K与压强P的关系且T1<T2 | C、 表示用0.1mol-L-1NaOH溶液分别滴定浓度均为0.1mol?L-1体积相同的盐酸和醋酸,其中的虚线是滴定醋酸的曲线 | D、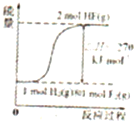 表示在相同条件下1 mol H2(g)与1 mol F2(g)反应生成2 mol HF(g)时,放出的热童为270kJ |
分析:A、金属和酸反应生成氢气的体积依据电子守恒计算分析判断;
B、反应是放热反应,温度越高平衡逆向进行,平衡常数减小;平衡常数随温度变化,不随压强变化;
C、等浓度的盐酸和醋酸溶液中氢离子浓度盐酸中大,pH小;
D、氢气和氟单质反应生成氟化氢的反应是放热反应,图象中表示的是吸热过程.
B、反应是放热反应,温度越高平衡逆向进行,平衡常数减小;平衡常数随温度变化,不随压强变化;
C、等浓度的盐酸和醋酸溶液中氢离子浓度盐酸中大,pH小;
D、氢气和氟单质反应生成氟化氢的反应是放热反应,图象中表示的是吸热过程.
解答:解:A、物质的量之比为2:3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系,镁反应快,2mol镁反应生成2mol氢气,3molAl完全反应生成氢气4.5mol,反应生成的气体不同,故A错误;
B、2SO2(g)+O2(g)?2SO3(g)(△H<0)反应是放热反应,温度越高平衡逆向进行,平衡常数减小,T1<T2;平衡常数随温度变化,不随压强变化,图象符合,故B正确;
C、用0.1mol?L-1NaOH溶液分别滴定浓度均为0.1mol?L-1体积相同的盐酸和醋酸,起始时醋酸溶液中氢离子浓度小,pH大,其中的虚线是滴定盐酸的曲线,故C错误;
D、相同条件下1 mol H2(g)与1 mol F2(g)反应生成2 mol HF(g)时,放出的热童为270kJ,图象中表示的反应物能量低于生成物,是吸热过程,故D错误;
故选B.
B、2SO2(g)+O2(g)?2SO3(g)(△H<0)反应是放热反应,温度越高平衡逆向进行,平衡常数减小,T1<T2;平衡常数随温度变化,不随压强变化,图象符合,故B正确;
C、用0.1mol?L-1NaOH溶液分别滴定浓度均为0.1mol?L-1体积相同的盐酸和醋酸,起始时醋酸溶液中氢离子浓度小,pH大,其中的虚线是滴定盐酸的曲线,故C错误;
D、相同条件下1 mol H2(g)与1 mol F2(g)反应生成2 mol HF(g)时,放出的热童为270kJ,图象中表示的反应物能量低于生成物,是吸热过程,故D错误;
故选B.
点评:本题考查了图象分析的方法和判断依据,注意图象的变化和起始量及对应反应特征的分析是解题关键,题目难度中等.

练习册系列答案
相关题目
下列图示与对应的叙述一定正确的是( )
A、图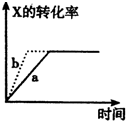 所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 | B、图 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 | C、图 所示,t1℃时质量分数均为20%的甲乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 所示,t1℃时质量分数均为20%的甲乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 | D、图 所示,用水稀释PH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a 所示,用水稀释PH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |


