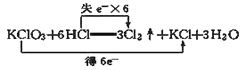
ЬтФПФкШн
ЁОЬтФПЁПвбжЊЗДгІ2CH3OH(g) ![]() CH3OCH3(g)ЃЋH2O(g)ЃЌдкФГЮТЖШЯТЕФЦНКтГЃЪ§ЮЊ400ЁЃДЫЮТЖШЯТЃЌдкУмБеШнЦїжаМгШыCH3OHЃЌЗДгІНјааЕНФГЪБПЬВтЕУИїзщЗжЕФХЈЖШШчЯТЃК
CH3OCH3(g)ЃЋH2O(g)ЃЌдкФГЮТЖШЯТЕФЦНКтГЃЪ§ЮЊ400ЁЃДЫЮТЖШЯТЃЌдкУмБеШнЦїжаМгШыCH3OHЃЌЗДгІНјааЕНФГЪБПЬВтЕУИїзщЗжЕФХЈЖШШчЯТЃК
ЮяжЪ | CH3OH | CH3OCH3 | H2O |
ХЈЖШ/molЁЄLЃ1 | 0.44 | 0.6 | 0.6 |
ЯТСаа№Ъіжае§ШЗЕФЪЧ(ЁЁЁЁ)
A.ИУЗДгІЕФЦНКтГЃЪ§БэДяЪНЮЊKЃН![]()
B.ЦНКтЪБc(CH3OH)ЃН0.04 molЁЄLЃ1
C.ИУЪБПЬе§ЁЂФцЗДгІЫйТЪЕФДѓаЁЃКvе§ЃМvФц
D.ШєМгШыCH3OHКѓЃЌО10 minЗДгІДяЕНЦНКтЃЌИУЪБМфФкЗДгІЫйТЪv(CH3OH)ЃН1.6 molЁЄLЃ1ЁЄminЃ1
ЁОД№АИЁПB
ЁОНтЮіЁП
A.2CH3OH(g) ![]() CH3OCH3(g)ЃЋH2O(g)ЕФЦНКтГЃЪ§БэДяЪНK=
CH3OCH3(g)ЃЋH2O(g)ЕФЦНКтГЃЪ§БэДяЪНK=![]() ЃЌЙЪAДэЮѓЃЛ
ЃЌЙЪAДэЮѓЃЛ
B.гЩБэжаЪ§ОнПЩжЊЃЌМзДМЕФЦ№ЪМХЈЖШЮЊ0.44mol/L+2ЁС0.6mol/L=1.64mol/LЃЌСюЦНКтКѓc(CH3OCH3)=xmol/LЃЌИљОнЗНГЬЪНПЩжЊЦНКтЪБc(CH3OH)=(1.642x)mol/LЃЌc(H2O)=xmol/LЃЌдђ![]() =400ЃЌНтЕУx=0.8ЃЌО10minДяЕНЦНКтЃЌДЫЪБc(CH3OH)=0.04mol/LЃЌЙЪBе§ШЗЃЛ
=400ЃЌНтЕУx=0.8ЃЌО10minДяЕНЦНКтЃЌДЫЪБc(CH3OH)=0.04mol/LЃЌЙЪBе§ШЗЃЛ
C. ХЈЖШЩЬQc=![]() =1.34<K=400ЃЌЗДгІЯђе§ЗДгІНјааЃЌДЫЪБе§ЁЂФцЗДгІЫйТЪЕФДѓаЁЃКvе§>vФцЃЌЙЪCДэЮѓЃЛ
=1.34<K=400ЃЌЗДгІЯђе§ЗДгІНјааЃЌДЫЪБе§ЁЂФцЗДгІЫйТЪЕФДѓаЁЃКvе§>vФцЃЌЙЪCДэЮѓЃЛ
D.10minДяЕНЦНКтЪБЃЌЗДгІЫйТЪv(CH3OH)=![]() =0.16mol/(Lmin)ЃЌЙЪDДэЮѓЃЌ
=0.16mol/(Lmin)ЃЌЙЪDДэЮѓЃЌ
ЙЪбЁBЁЃ

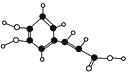
ЁОЬтФПЁПБНМзЫсввѕЅЃЈC9H10O2ЃЉЩдгаЫЎЙћЦјЮЖЃЌгУгкХфжЦЯуЫЎЯуОЋКЭШЫдьОЋгЭЃЌДѓСПгУгкЪГЦЗЙЄвЕжаЃЌвВПЩгУзїгаЛњКЯГЩжаМфЬхЁЂШмМСЕШЃЎЦфжЦБИЗНЗЈЮЊЃК
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
вбжЊЃК
беЩЋЁЂзДЬЌ | ЗаЕуЃЈЁцЃЉ | УмЖШЃЈgcmЉ3ЃЉ | |
БНМзЫс* | ЮоЩЋЦЌзДОЇан | 249 | 1.2659 |
БНМзЫсввѕЅ | ЮоЩЋГЮЧхвКЬх | 212.6 | 1.05 |
ввДМ | ЮоЩЋГЮЧхвКЬх | 78.3 | 0.7893 |
ЛЗМКЭщ | ЮоЩЋГЮЧхвКЬх | 80.8 | 0.7318 |
*БНМзЫсдк100ЁцЛсбИЫйЩ§ЛЊЃЎЪЕбщВНжшШчЯТЃК
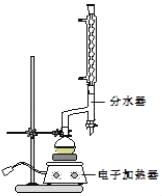
ЂйдкдВЕзЩеЦПжаМгШы12.20gБНМзЫсЁЂ25mLввДМЃЈЙ§СПЃЉЁЂ20mLЛЗМКЭщЃЌвдМА4mLХЈСђЫсЃЌЛьКЯОљдШВЂМгШыЗаЪЏЃЌАДШчЭМЫљЪОзАКУвЧЦїЃЌПижЦЮТЖШдк6570ЁцМгШШЛиСї2hЃЎЗДгІЪБЛЗМКЭщвЛввДМЉЫЎЛсаЮГЩЁАЙВЗаЮяЁБЃЈЗаЕу62.6ЁцЃЉеєСѓГіРДЃЌдйРћгУЗжЫЎЦїВЛЖЯЗжРыГ§ШЅЗДгІЩњГЩЕФЫЎЃЌЛиСїЛЗМКЭщКЭввДМЃЎ
ЂкЗДгІНсЪјЃЌДђПЊа§ШћЗХГіЗжЫЎЦїжавКЬхКѓЃЌЙиБеа§ШћЃЎМЬајМгШШЃЌжСЗжЫЎЦїжаЪеМЏЕНЕФвКЬхВЛдйУїЯддіМгЃЌЭЃжЙМгШШЃЎ
ЂлНЋЩеЦПФкЗДгІвКЕЙШЫЪЂгаЪЪСПЫЎЕФЩеБжаЃЌЗжХњМгШыNa2CO3жСШмвКГЪжаадЃЎ
ЂмгУЗжвКТЉЖЗЗжГігаЛњВуЃЌЫЎВугУ25mLввУбнЭШЁЗжвКЃЌШЛКѓКЯВЂжСгаЛњВуЃЎМгШыТШЛЏИЦЃЌЖдДжВњЮяНјааеєСѓЃЈзАжУШчЭМЫљЪОЃЉЃЌЕЭЮТеєГіввУбКѓЃЌМЬајЩ§ЮТЃЌНгЪе210213ЁцЕФСѓЗжЃЎ
ЂнМьбщКЯИёЃЌВтЕУВњЦЗЬхЛ§ЮЊ13.16mLЃЎ
ЃЈ1ЃЉдкИУЪЕбщжаЃЌдВЕзЩеЦПЕФШнЛ§зюЪЪКЯЕФЪЧ_____ЃЈЬюШые§ШЗбЁЯюЧАЕФзжФИЃЉЃЎ
A.25mL B.50mL C.100mL D.250mL
ЃЈ2ЃЉВНжшЂйжаЗаЪЏЕФзїгУЪЧ____ЃЌЪЙгУЗжЫЎЦїВЛЖЯЗжРыГ§ШЅЫЎЕФФПЕФЪЧ_____ЃЎ
ЃЈ3ЃЉжшЂкжагІПижЦСѓЗжЕФЮТЖШдк__ЃЎ
A.215220Ёц B.8590Ёц C.7880Ёц D.6570Ёц
ЃЈ4ЃЉВНжшЂлМгШыNa2CO3ЕФзїгУЪЧ________ЃЛШєNa2CO3МгШыВЛзуЃЌдкжЎКѓеєСѓЪБЃЌеєСѓЩеЦПжаПЩМћЕНАзбЬЩњГЩЃЌВњЩњИУЯжЯѓЕФдвђЪЧ________ЃЎ
ЃЈ5ЃЉЙигкВНжшЂмжаЕФнЭШЁЗжвКВйзїа№Ъіе§ШЗЕФЪЧ____ЃЎ
AЃЎЫЎШмвКжаМгШыввУбЃЌзЊвЦжСЗжвКТЉЖЗжаЃЌШћЩЯВЃСЇШћЃЌЗжвКТЉЖЗЕЙзЊЙ§РДЃЌгУСІеёвЁ
BЃЎеёвЁМИДЮКѓашДђПЊЗжвКТЉЖЗЯТПкЕФВЃСЇШћЗХЦј
CЃЎОМИДЮеёвЁВЂЗХЦјКѓЃЌЪжГжЗжвКТЉЖЗОВжУД§вКЬхЗжВу
DЃЎЗХГівКЬхЪБЃЌгІДђПЊЩЯПкВЃСЇШћЛђНЋВЃСЇШћЩЯЕФАМВлЖдзМТЉЖЗПкЩЯЕФаЁПз
ЃЈ6ЃЉМЦЫуБОЪЕбщЕФВњТЪЮЊ____ЃЎ
ЁОЬтФПЁПгЩAЁЂBЁЂCЁЂDЫФжжН№ЪєАДЯТБэжазАжУНјааЪЕбщЁЃ
зАжУ |
|
|
|
ЯжЯѓ | ЖўМлН№ЪєAВЛЖЯШмНт | CЕФжЪСПдіМг | AЩЯгаЦјЬхВњЩњ |
ИљОнЪЕбщЯжЯѓЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉзАжУМзжаИКМЋЕФЕчМЋЗДгІЪНЪЧ______________________________________ЁЃ
ЃЈ2ЃЉзАжУввжае§МЋЕФЕчМЋЗДгІЪНЪЧ_______________________________________ЁЃ
ЃЈ3ЃЉзАжУБћжаШмвКЕФpH________ЃЈЬюЁАБфДѓЁБЁЂЁАБфаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ЃЈ4ЃЉЫФжжН№ЪєЛюЖЏадгЩЧПЕНШѕЕФЫГађЪЧ___________________________________ЁЃ