题目内容
9.X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体.W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.下列说法正确的是( )| A. | 最高价氧化物对应水化物的碱性:Y>W | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 原子半径:Y<Z | |
| D. | Y最高价氧化物能与W的最高价氧化物的水化物的溶液反应 |
分析 X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;Y、Z位于同周期,Z单质是一种良好的半导体,则Z为Si;W、Y为金属元素,结合原子序数可知,W为K、Ca中的一种,Y为Na、Mg、Al中的一种,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,则Y、W原子最外层电子数之差为6-4=2,故Y为Al、W为K,据此解答.
解答 解:X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;Y、Z位于同周期,Z单质是一种良好的半导体,则Z为Si;W、Y为金属元素,结合原子序数可知,W为K、Ca中的一种,Y为Na、Mg、Al中的一种,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,则Y、W原子最外层电子数之差为6-4=2,故Y为Al、W为K.
A.Y为Al、W为K,金属性K>Al,故碱性KOH>Al(OH)3,故A错误;
B.X为O,Z为Si,非金属性O>Si,故氢化物稳定性H2O>SiH4,故B错误;
C.同周期自左而右原子半径减小,故原子半径Al>Si,故C错误;
D.Y最高价氧化物能为氧化铝,W的最高价氧化物的水化物为KOH,氧化铝与氢氧化钾反应生成偏铝酸钾与水,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,知道氧化铝的两性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.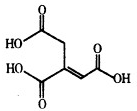 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
 乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )
乌头酸的结构简式如图所示,下列关于乌头酸的说法正确的是( )| A. | 乌头酸与醋酸是同系物 | |
| B. | 乌头酸中碳元素的质量分数为41.4% | |
| C. | 乌头酸能发生中和反应、水解反应、酯化反应 | |
| D. | 含1mol乌头酸的溶液最多可消耗3mol NaOH、3mol Br2 |
4.下列关于元素性质的有关叙述中不正确的是( )
| A. | C、N、O、F的原子半径依次减小 | |
| B. | Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | C、N、O、F的最高正价依次升高 | |
| D. | Na、Mg、Al、Si的最外层电子数依次增加 |
1.下列元素中,不属于主族元素的是( )
| A. | 钡 | B. | 铁 | C. | 钙 | D. | 碘 |
 .
. .
. .
.