题目内容
16.下列说法中,正确的是( )| A. | 含有羟基的化合物一定属于醇类 | |
| B. | 含有跟链烃基相连的羟基的有机物一定是醇类 | |
| C. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| D. | 分子内有苯环和羟基的化合物一定是酚类 |
分析 A.羟基与烃基或苯环侧链相连的是醇,与苯环相连的是酚;
B.羟基与烃基或苯环侧链相连的是醇,与苯环相连的是酚;
C.酚具有弱酸性;
D.苯环可通过链烃基再与羟基相连则形成醇类.
解答 解:A.羟基与苯环相连的是酚,故A错误;
B.含有跟链烃基相连的羟基的有机物一定是醇类,故B正确;
C.酚具有弱酸性,而醇则没有弱酸性,故C错误;
D.苯环可通过链烃基再与羟基相连则形成醇类.如  ,故D错误.
,故D错误.
故选B.
点评 本题考查醇和酚的区别,注意羟基与烃基或苯环侧链相连的是醇,与苯环相连的是酚,较简单.

练习册系列答案
相关题目
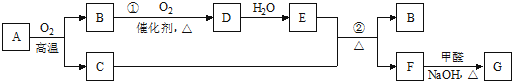
6.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
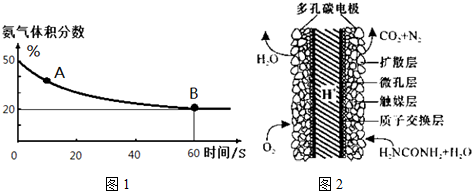
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)

(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
4.人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法不正确的是( )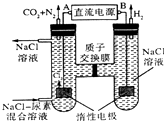

| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极,左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
11.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应可以制造价值更高的化学品. (1)250℃时,以镍合金为催化剂,向4L密闭容器中通入6molCO2、4molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分的浓度为:
①在该条件下达平衡时,CH4的转化率为50%
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
求反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3KJkJ•mol-1
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4?CH3COOH温度与催化剂的催化效率和乙酸的生成速率(如图1).请回答下列问题:
①250-300℃时,温度升高而乙酸的生成速率降低的原因是温度在250~300℃时,催化剂的催化效率降低
②为提高上述反应CH4的转化率,可采取的措施有增大反应压强、增大CO2的浓度(写2条)
(3)Li4SiO4可用于吸收、释放CO2,原理是:500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反方向和逆反应方向的条件):CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理(如图2)所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
a.100℃以下 b.100℃-300℃
c.300℃-350℃d.350℃-2050℃
②放电时,电极A为负极.
③充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS
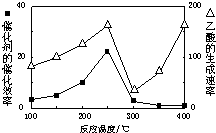
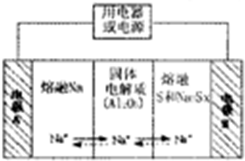
图1 图2.
| 物质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol•L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
求反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3KJkJ•mol-1
(2)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2+CH4?CH3COOH温度与催化剂的催化效率和乙酸的生成速率(如图1).请回答下列问题:
①250-300℃时,温度升高而乙酸的生成速率降低的原因是温度在250~300℃时,催化剂的催化效率降低
②为提高上述反应CH4的转化率,可采取的措施有增大反应压强、增大CO2的浓度(写2条)
(3)Li4SiO4可用于吸收、释放CO2,原理是:500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反方向和逆反应方向的条件):CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理(如图2)所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
c.300℃-350℃d.350℃-2050℃
②放电时,电极A为负极.
③充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-=xS


图1 图2.
8.在电治铝的电解槽中存在电解质W2[X2Y2Z4],己知四种元素的简单离子的电子层结构均相同,Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半,下列说法正确的是( )
| A. | 原子序数:W>X>Y>Z | |
| B. | 原子半径:W>X>Y>Z | |
| C. | W的最高价氧化物的水化物碱性比X的弱 | |
| D. | Y的简单氢化物的稳定性比Z的强 |
5.硼烷氨的化学式为H6NB,它是乙烷的等电子体,结构与乙烷类似.硼烷氨是最基本的硼氨化合物,因为氢经济的发展,硼烷氨因其稳定的储氢能力引起人们关注.下列有关硼烷氨的说法中正确的是( )
| A. | 原子半径:B<N | |
| B. | 硼烷氨分子与乙烷分子结构相似,分子内既含有极性共价键又含有非极性共价键 | |
| C. | 硼烷氨分子中的每个原子均达到最外层8电子稳定结构 | |
| D. | 硼烷氨分子中所有的H原子不可能在同一个平面内 |
11.运用元素周期律分析下面推断,其中错误的是( )
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 | |
| C. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| D. | 铍(Be)的氧化物的水化物可能具有两性 |