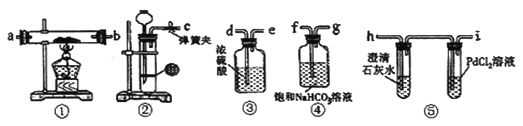
题目内容
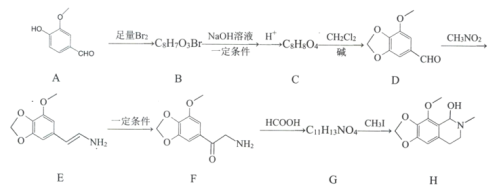
【题目】那可丁是一种药物,该药物适用于刺激性干咳病人服用,无成瘾性,化合物H是制备该药物的重要中间体,合成路线如下:
已知:①
②RNH2 ![]() RNHCH3
RNHCH3
(1)化合物B的结构简式:________
(2)反应B→C的第一步反应类型:____________
(3)下列说法正确的是:___________。
A.物质D能与FeCl3发生显色反应 B.物质F具有碱性
C.物质G能和银氨溶液发生反应 D.物质H的分子式是C12H15NO4
(4)写出C→D的化学方程式:____________________________
(5)请写出化合物H满足下列条件的所有同分异构体的结枸简式:_______________
①分子中含苯环,无其他环状结构
②分子中含有-NO2且直接连在苯环上
③分子中只有3种不同化学环境的氢
(6)已知![]() ,请以
,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物![]() ,写出制备的合成路线流程图(无机试剂任选)__________________________
,写出制备的合成路线流程图(无机试剂任选)__________________________
【答案】 取代反应 BD
取代反应 BD  或
或



【解析】
A含有酚羟基和醛基和醚键,酚羟基能与溴发生反应,在酚羟基的邻位发生取代反应,故B的结构为 ,其与氢氧化钠反应,酚羟基能发生酸碱中和,溴原子发生取代反应,再在酸的条件下得到C,结构为
,其与氢氧化钠反应,酚羟基能发生酸碱中和,溴原子发生取代反应,再在酸的条件下得到C,结构为 。根据各物质的官能团分析其具有的性质。
。根据各物质的官能团分析其具有的性质。
(1)A含有酚羟基和醛基和醚键,酚羟基能与溴发生反应,在酚羟基的邻位发生取代反应,故B的结构为 ;
;
(2)B在氢氧化钠的条件下反应,是酚羟基和溴原子与氢氧化钠的反应,属于取代反应;
(3)A.含有酚羟基的物质能与FeCl3发生显色反应,而物质D不含酚羟基,故错误;B.物质F含有氨基,具有碱性,故正确;C.物质G不含醛基,不能和银氨溶液发生反应,故错误;D.物质H  的分子式是C12H15NO4,故正确,故选BD。
的分子式是C12H15NO4,故正确,故选BD。
(4)结合信息①分析,C→D的化学方程式为
 ;
;
(5)H的分子式是C12H15NO4,其同分异构体要满足以下条件:①分子中含苯环,无其他环状结构, ②分子中含有-NO2且直接连在苯环上,③分子中只有3种不同化学环境的氢,说明结构有对称性,则除了苯环外其余的6个碳原子中,有4个碳以甲基形式位于对称轴两侧,另外还有2个碳原子和2个氧原子和3个氢原子形成一个支链连接在苯环上,即连接在硝基的对位,结构可能如下:

 ;
;
(6)合成 ,逆推方法,需要合成CH2ClCHClCH2Cl,逆推需要合成CH2=CHCH2Cl,再需要CH2=CHCH3,由CH3CHCICH3发生消去反应即可,故合成路线为:
,逆推方法,需要合成CH2ClCHClCH2Cl,逆推需要合成CH2=CHCH2Cl,再需要CH2=CHCH3,由CH3CHCICH3发生消去反应即可,故合成路线为:


【题目】硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为________。
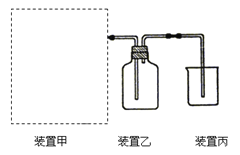
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
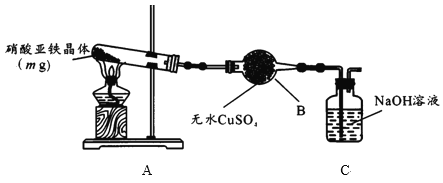
①仪器B的名称是____,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有___。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
实验步骤 | 现象 |
取少量固体加适量稀硫酸,振荡,将溶液分成两份 | 固体溶解得黄色溶液 |
一份滴入____ | 溶液变成红色 |
另一份滴入1~2滴K3 [Fe(CN)6]溶液 | ___________ |
A中硝酸亚铁晶体[Fe(NO3)2·xH2O]分解的化学方程式为______ 。
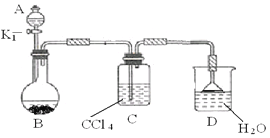
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴___作指示剂。
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为______。
【题目】实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
实验 | 装置 | 试剂x | 操作及现象 |
Ⅰ |
| 1 mol·L1 CuCl2溶液 | 加入2mL CuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
Ⅱ | 1 mol·L1 CuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
已知:Ⅰ.Cu2+![]() [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
Ⅱ. Cu+![]() [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液)![]() [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_______,反应的离子方程式为_______。
(2)对实验 Ⅰ 产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
① 假设a不合理,实验证据是_______;
② 实验表明假设b合理,实验I反应的离子方程式有_____、H+ + HSO3- = SO2↑+H2O。
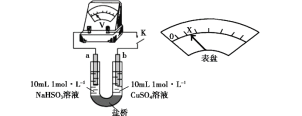
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_______(补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ: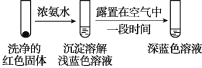
证实红色沉淀中含有Cu+的实验证据是_______;
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:_______。