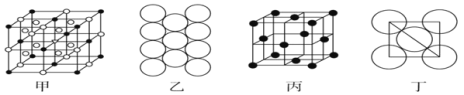
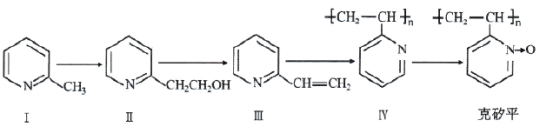
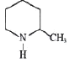
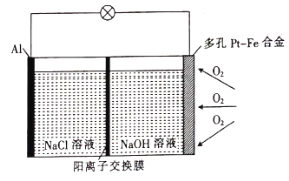
题目内容
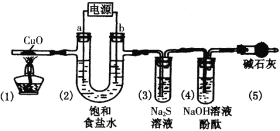
【题目】某化学小组利用如图所示装置比较浓、稀硝酸氧化性的强弱。

实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.加入相应试剂,关闭弹簧夹,打开试管①,向其中加入适量的![]() 粉末,立即盖上橡皮塞;
粉末,立即盖上橡皮塞;
Ⅲ.将铜丝伸入浓硝酸中,观察现象;
Ⅳ.将铜丝提起,打开弹簧夹,再向装置①中通入一定量的CO2气体……
回答下列问题:
(1)检查该装置气密性的方法为____________________________________________________________。
(2)加入少量![]() 粉末的作用为________________________;通入一定量的CO2气体的作用为________________________。
粉末的作用为________________________;通入一定量的CO2气体的作用为________________________。
(3)将铜丝伸入浓硝酸中,立即观察到试管①中有红棕色气体生成,发生反应的化学方程式为_________________________;红棕色气体进入试管②中后变成无色,发生反应的化学方程式为______________________________,试管③液面上方无红棕色气体出现,试管④液面上方产生红棕色气体同时溶液出现黄色,则试管④中发生反应的化学方程式为______________________________,说明浓硝酸的氧化性强于稀硝酸。
(4)NO2与氢氧化钠溶液反应生成两种盐,其离子方程式为______________________________。
【答案】关闭弹簧夹,将⑤中导管末端伸入盛有水的烧杯中,用酒精灯微热试管①,观察到烧杯中有气泡产生,停止加热,导管内形成一段水柱 与硝酸反应产生CO2,将装置中的空气赶出 将装置中的有毒气体赶入NaOH溶液中,使之被吸收 



【解析】
连接好装置,并检查装置的气密性,加入相应试剂,关闭弹簧夹,打开试管①,向其中加入适量的![]() 粉末,其可与硝酸反应产生CO2,CO2可将装置中的空气赶出;将铜丝伸入浓硝酸中,生成二氧化氮,二氧化氮进入试管②中与水反应生成一氧化氮,一氧化氮分别进入试管③和试管④,通过观察实验现象,从而比较浓、稀硝酸氧化性的强弱,将铜丝提起,反应结束,打开弹簧夹,再向装置①中通入一定量的CO2气体,将装置中的有毒气体赶入NaOH溶液中,使之被吸收。
粉末,其可与硝酸反应产生CO2,CO2可将装置中的空气赶出;将铜丝伸入浓硝酸中,生成二氧化氮,二氧化氮进入试管②中与水反应生成一氧化氮,一氧化氮分别进入试管③和试管④,通过观察实验现象,从而比较浓、稀硝酸氧化性的强弱,将铜丝提起,反应结束,打开弹簧夹,再向装置①中通入一定量的CO2气体,将装置中的有毒气体赶入NaOH溶液中,使之被吸收。
(1)检查该装置的气密性时,首先形成封闭体系,然后产生压强差,故方法为关闭弹簧夹,将⑤中导管末端伸入盛有水的烧杯中,用酒精灯微热试管①,观察到烧杯中有气泡产生,停止加热,导管内形成一段水柱;
(2)加入少量![]() 粉末,其可与硝酸反应产生CO2,将装置中的空气赶出,防止空气中的氧气氧化装置②中生成的一氧化氮,干扰实验;反应结束后,通入一定量的CO2气体可以将装置中的有毒气体赶入NaOH溶液中,使之被吸收,防止污染环境;
粉末,其可与硝酸反应产生CO2,将装置中的空气赶出,防止空气中的氧气氧化装置②中生成的一氧化氮,干扰实验;反应结束后,通入一定量的CO2气体可以将装置中的有毒气体赶入NaOH溶液中,使之被吸收,防止污染环境;
(3)将铜丝伸入浓硝酸中,立即观察到试管①中有红棕色气体生成,铜与浓硝酸反应生成硝酸铜、二氧化氮和水,发生反应的化学方程式为 ;二氧化氮气体进入试管②中后变成无色,其与水反应生成一氧化氮和硝酸,发生反应的化学方程式为
;二氧化氮气体进入试管②中后变成无色,其与水反应生成一氧化氮和硝酸,发生反应的化学方程式为 ;试管④液面上方产生红棕色气体同时溶液出现黄色,说明一氧化氮被浓硝酸氧化生成二氧化氮,则应发生归中反应,试管④中发生反应的化学方程式为
;试管④液面上方产生红棕色气体同时溶液出现黄色,说明一氧化氮被浓硝酸氧化生成二氧化氮,则应发生归中反应,试管④中发生反应的化学方程式为 ,说明浓硝酸的氧化性强于稀硝酸;
,说明浓硝酸的氧化性强于稀硝酸;
(4)NO2与氢氧化钠溶液反应生成硝酸钠和亚硝酸钠和水,其离子方程式为 。
。

【题目】煤燃烧排放的烟气含有SO2和NOx,大量排放烟气形成酸雨、污染大气,因此对烟气进行脱硫、脱硝,对环境保护有重要意义。回答下列问题:
Ⅰ.利用CO脱硫
(1)工业生产可利用CO气体从燃煤烟气中脱硫,则25℃时CO从燃煤烟气中脱硫的热化学方程式2CO(g)+SO2(g)2CO2(g)+S(s)的焓变△H=_____________。25℃,100kPa时,由元素最稳定的单质生成1mol纯化合物时的反应热称为标准摩尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示:
物质 | CO(g) | CO2(g) | SO2(g) |
标准摩尔生成焓fHm(25℃)/kJmol-1 | -110.5 | -393.5 | -296.8 |
(2)在模拟脱硫的实验中,向多个相同的体积恒为2L的密闭容器中分别通入2.2mol CO和1mol SO2气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。
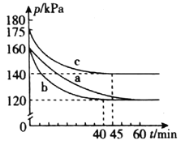
①在实验b中,40 min达到平衡,则0~40 min用SO2表示的平均反应速率v(SO2)=_______。
②与实验a相比,实验b可能改变的条件为_______________,实验c可能改变的条件为_________________。
Ⅱ.利用NH3脱硝
(3)在一定条件下,用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H=-1807.98kJ·mol-1。在刚性容器中,NH3与NO的物质的量之比分别为X、Y、Z(其中X<Y<Z),在不同温度条件下,得到NO脱除率(即NO转化率)曲线如图所示。
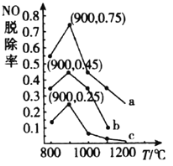
①NH3与NO的物质的量之比为X时对应的曲线为_____________(填“a”“b”或“c”)。
②各曲线中NO脱除率均先升高后降低的原因为__________。
③900℃条件下,设Z=![]() ,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
Ⅲ.利用NaCIO2脱硫脱硝
(4)利用NaClO2的碱性溶液可吸收SO2和NO2(物质的量之比为1:1)的混合气体,自身转化为NaCl,则反应的离子方程式为________________。