题目内容
【题目】CO甲烷化反应为:CO(g)+3H2(g)=CH4(g)+H2O(l)。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢。
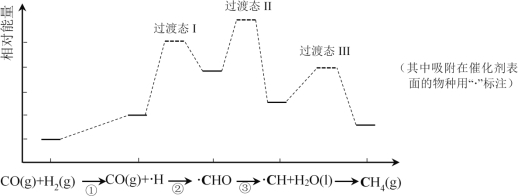
下列说法不正确的是( )
A.步骤①只有非极性键断裂
B.步骤②速率最慢的原因可能是其活化能最高
C.步骤③需要吸收热量
D.使用该催化剂不能有效提高CO的平衡转化率
【答案】C
【解析】
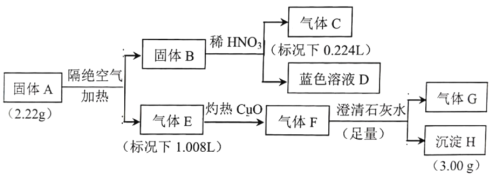
A. 根据图示可知:在步骤①中,反应开始时是CO气体和H2,后来反应变为CO气体和![]() ,只断裂了H2中的H-H键,同种元素形成的共价键是非极性键,因此步骤①发生只有非极性键断裂,A正确;
,只断裂了H2中的H-H键,同种元素形成的共价键是非极性键,因此步骤①发生只有非极性键断裂,A正确;
B. 步骤②是CO气体与![]() 结合形成
结合形成![]() ,由于该过渡态的相对能量较反应物高,需吸收较多能量才能发生该反应,所以反应速率较慢,B正确;
,由于该过渡态的相对能量较反应物高,需吸收较多能量才能发生该反应,所以反应速率较慢,B正确;
C. 反应物的能量比生成物的能量高,所以发生步骤③的反应会放出热量,C错误;
D.催化剂只能改变反应途径,降低反应的活化能,但不能改变反应物、生成物的能量,因此不能使化学平衡发生移动,故使用该催化剂不能有效提高CO的平衡转化率,D正确;
答案选C。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目