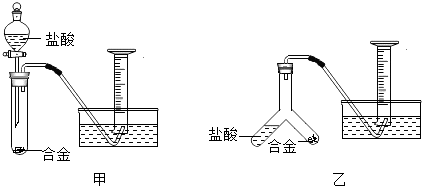
题目内容
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2 , 反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为
②下列选项能判断该反应达到平衡状态的依据的有
A.2v(H2)=v(CH3OH) B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣akJmol﹣1
②2CO(g)+O2(g)=2CO2(g)△H=﹣bklmol﹣1
③H2O(g)=H2O(1)△H=﹣ckJmol﹣1
则CH3OH(1)+O2(g)═CO(g)+2H2O(1)△H=kJmol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为 .
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 .
【答案】
(1)极性
(2)60%;CE
(3)![]() (b﹣a﹣4c)
(b﹣a﹣4c)
(4)CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;3.2g
【解析】解:(1.)甲醇分子结构不对称,分子中正负电荷正向不重合,属于极性分子,
所以答案是:极性;
(2.)①恒温恒容下,压强之比等于气体物质的量之比,平衡时混合气体物质的量为(1mol+2mol)× ![]() =1.8mol,则:
=1.8mol,则:
CO(g)+2H2(g)CH3OH(g)物质的量减小
1 2
0.6mol 3mol﹣1.8mol=1.2mol
则CO的转化率为 ![]() ×100%=60%,
×100%=60%,
所以答案是:60%;
②A.未指明正逆速率,不能说明到达平衡,若分别表示正逆速率,反应到达平衡,故A错误;
B.CO的消耗速率等于CH3OH的生成速率,均表示正反应速率,反应始终按该比例关系进行,故B错误;
C.随反应进行混合气体物质的量变化,恒温恒容下,容器内的压强发生变化,若容器内压强保持不变,说明反应到达平衡,故C正确;
D.混合气体总质量不变,容器的容积不变,混合气体的密度始终保持不变,故D错误;
E.混合气体总质量不变,随反应进行混合气体物质的量变化,则平均相对分子质量发生变化,混合气体的平均相对分子质量不随时间而变化,说明反应到达平衡,故E正确,
故选:CE;
(3.)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣akJmol﹣1
②2CO(g)+O2(g)=2CO2(g)△H=﹣bklmol﹣1
③H2O(g)=H2O(1)△H=﹣ckJmol﹣1
根据盖斯定律,(①﹣②+③×4)÷2可得:CH3OH(1)+O2(g)═CO(g)+2H2O(1),△H= ![]() [﹣a﹣(﹣b)﹣4c]kJ/mol=
[﹣a﹣(﹣b)﹣4c]kJ/mol= ![]() (b﹣a﹣4c)kJ/mol,
(b﹣a﹣4c)kJ/mol,
所以答案是: ![]() (b﹣a﹣4c);
(b﹣a﹣4c);
(4.)①原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,
所以答案是:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;
②溶液中n(Cu2+)=0.2L×0.5mol/L=0.1mol,n(H+)=0.2L×2mol/L=0.4mol,c(Cl﹣)=0.2L×2mol/L=0.4mol,
开始阶段,阴极电极反应为:Cu2++2e﹣=Cu,阳极电极反应为:2Cl﹣﹣2e﹣=Cl2↑,电解一段时间后,当两极收集到相同体积(相同条件)的气体,且阳极生成氧气,则阴极还发生反应:2H++2e﹣=H2↑,阳极还发生:4OH﹣﹣4e﹣=2H2O+O2↑,阳极生成氯气为0.2mol,假设氧气为xmol,则氢气为(x+0.2)mol,根据电子转移守恒,则0.1mol×2+(x+0.2)mol×2=0.2mol×2+xmol×4,解得x=0.1,故收集氧气的质量为0.1mol×32g/mol=3.2g,
所以答案是:3.2g.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是(填元素符号)。
(2)元素⑧的原子结构示意图是;由①、④、⑥三种元素组成的化合物,其电子式是。
(3)元素②、⑧的气态氢化物的稳定性较强的是(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是(填化学式)。
(4)③、④、⑧三种元素的原子半径由大到小的顺序是(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是