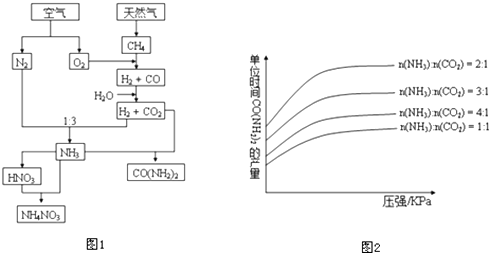
题目内容
【题目】X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X、Y与稀硫酸构成原电池时,Y为负极。X、Y、Z三种金属的活动性顺序为
A. Y>X>ZB. X>Z>YC. Y>Z>XD. X>Y>Z
【答案】A
【解析】
把X浸入Z的硝酸盐溶液中,X的表面有Z析出,说明金属X可以把金属Z从其盐中置换出来,活泼性X>Z;X和Y组成原电池时,Y为电池的负极,所以活泼性Y>X;因此X、Y、Z三种金属的活动性顺序为Y>X>Z。故选A。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】温度为T℃时,向2.0L恒容密闭容器中充入1.0molPCl5 , 反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11molL﹣1 , 则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2 , 达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl5、2.0molCl2 , 达到平衡时,PCl5的转化率大于20%
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示: 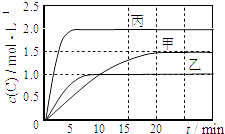
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 | 1.5molA | 1.5molA | 6.0molA |
下列说法正确的是( )
A.x=1
B.10min内乙容器中反应的平均速率v(B)=0.025molL﹣1min﹣1
C.由图可知:T1<T2 , 且该反应为吸热反应
D.T1℃,起始时甲容器中充入0.5molA,1.5molB,平衡时A的转化率为75%
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2 , 反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为
②下列选项能判断该反应达到平衡状态的依据的有
A.2v(H2)=v(CH3OH) B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣akJmol﹣1
②2CO(g)+O2(g)=2CO2(g)△H=﹣bklmol﹣1
③H2O(g)=H2O(1)△H=﹣ckJmol﹣1
则CH3OH(1)+O2(g)═CO(g)+2H2O(1)△H=kJmol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为 .
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为 .