题目内容
有原子序数依次增大的A、B、C、D、E 五种元素,A 是短周期中族序数等于周期数的非金属元素;B 元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C 元素的价电子构型为nsnnpn+1;D 的最外层电子数与电子层数之比为3:1;E 是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大.
(1)E元素在周期表中的位置 ;E元素价电子排布式为 .
(2)A 分别与B、C、D 能形成电子数为 10 的化合物,它们的沸点由高到低的顺序是 ( 写分子式).
(3)B 与D 形成的非极性分子的电子式为 .
(4)B、C、D 三种元素的第一电离能由大到小的顺序是 (用元素符号表示).
(5)C 的单质分子中σ键和π键的个数比为 .
(6)已知在25℃、101kPa 下:ABC(aq)+A2D(1)═BC-(aq)+A3 D+(aq)△H=+45.6kJ?mol-1
A3 D+(aq)+DA-(aq)═2A2D(1)△H=-57.3kJ?mol-1
则在25℃、101kPa 的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示) .
(1)E元素在周期表中的位置
(2)A 分别与B、C、D 能形成电子数为 10 的化合物,它们的沸点由高到低的顺序是
(3)B 与D 形成的非极性分子的电子式为
(4)B、C、D 三种元素的第一电离能由大到小的顺序是
(5)C 的单质分子中σ键和π键的个数比为
(6)已知在25℃、101kPa 下:ABC(aq)+A2D(1)═BC-(aq)+A3 D+(aq)△H=+45.6kJ?mol-1
A3 D+(aq)+DA-(aq)═2A2D(1)△H=-57.3kJ?mol-1
则在25℃、101kPa 的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示)
考点:位置结构性质的相互关系应用
专题:
分析:原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素,则A为H元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同,则B为碳元素;C 元素的价电子构型为nsnnpn+1,由于s能级最多容纳2个电子,且p能级容纳电子,故n=2,则C为N元素;D 的最外层电子数与电子层数之比为3:1,原子只能有2个电子层,最外层电子数为6,故D为O元素;E 是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大,则E为Fe,据此解答.
解答:
解:原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素,则A为H元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同,则B为碳元素;C 元素的价电子构型为nsnnpn+1,由于s能级最多容纳2个电子,且p能级容纳电子,故n=2,则C为N元素;D 的最外层电子数与电子层数之比为3:1,原子只能有2个电子层,最外层电子数为6,故D为O元素;E 是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大,则E为Fe,
(1)E为Fe,元素在周期表中的位置是第四周期第Ⅷ族;E元素价电子排布式为3d64s2,故答案为:第四周期第Ⅷ族;3d64s2;
(2)A分别与B、C、D 能形成电子数为10 的化合物分别为CH4、NH3、H2O,常温下水为液体,而甲烷、氨气为气体,水的沸点最高,而氨气分子之间存在氢键,沸点高于甲烷,故沸点由高到低的顺序是:H2O>NH3>CH4,故答案为:H2O>NH3>CH4;
(3)B 与D 形成的非极性分子为CO2,电子式为 ,故答案为:
,故答案为: ;
;
(4)同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,故答案为:N>O>C;
(5)C 的单质分子为N2,其结构为N≡N,分子中σ键和π键的个数比为1:2,故答案为:1:2;
(6)已知在25℃、101kPa 下:HCN(aq)+H2O(1)═CN-(aq)+H3 O+(aq)△H=+45.6kJ?mol-1
H3 O+(aq)+OH-(aq)═2H2O(1)△H=-57.3kJ?mol-1
两热化学方程式相加可得:HCN(aq)+OH-(aq)═CN-(aq)+H2O(1)△H=-11.7kJ?mol-1
故答案为:HCN(aq)+OH-(aq)═CN-(aq)+H2O(1)△H=-11.7kJ?mol-1.
(1)E为Fe,元素在周期表中的位置是第四周期第Ⅷ族;E元素价电子排布式为3d64s2,故答案为:第四周期第Ⅷ族;3d64s2;
(2)A分别与B、C、D 能形成电子数为10 的化合物分别为CH4、NH3、H2O,常温下水为液体,而甲烷、氨气为气体,水的沸点最高,而氨气分子之间存在氢键,沸点高于甲烷,故沸点由高到低的顺序是:H2O>NH3>CH4,故答案为:H2O>NH3>CH4;
(3)B 与D 形成的非极性分子为CO2,电子式为
 ,故答案为:
,故答案为: ;
;(4)同周期随原子序数增大,第一电离能呈增大趋势,但N原子2P能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,故答案为:N>O>C;
(5)C 的单质分子为N2,其结构为N≡N,分子中σ键和π键的个数比为1:2,故答案为:1:2;
(6)已知在25℃、101kPa 下:HCN(aq)+H2O(1)═CN-(aq)+H3 O+(aq)△H=+45.6kJ?mol-1
H3 O+(aq)+OH-(aq)═2H2O(1)△H=-57.3kJ?mol-1
两热化学方程式相加可得:HCN(aq)+OH-(aq)═CN-(aq)+H2O(1)△H=-11.7kJ?mol-1
故答案为:HCN(aq)+OH-(aq)═CN-(aq)+H2O(1)△H=-11.7kJ?mol-1.
点评:本题考查结构性质位置关系综合考查,推断元素是解题关键,注意理解掌握同周期第一电离能异常原因,理解掌握利用盖斯定律进行热化学方程式书写、反应热计算等,难度中等.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
下列表示化学反应的离子方程式正确的是( )
| A、将过量SO2气体通入氨水中:SO2+2NH3+H2O═2NH 4 ++SO32-+H2O |
| B、向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2═2Ee3++I2+4Cl |
| C、向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-═BaCO3↓+2H2O+CO32- |
| D、硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I═Fe2++5I2+3NO↑+6H2O |
下列叙述错误的是( )
| A、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| B、用高锰酸钾酸性溶液可区分己烷和3-己烯 |
| C、用水可区分苯和溴苯 |
| D、用金属钠可区分乙醇和乙醚 |
下列关于有机物的说法正确的是( )
| A、乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同 |
| B、交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应 |
| C、乙酸的分子式为CH3COOH,属于弱电解质 |
| D、苯分子中没有碳碳双键,因此苯不能发生加成反应 |
下列说法不正确的是( )
| A、有些金属晶体比原子晶体熔沸点高 |
| B、晶体只要有阴离子就一定有阳离子 |
| C、原子晶体中一定有非极性共价键 |
| D、分子晶体中不一定有共价键 |
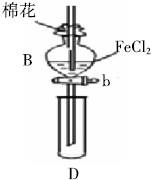 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:

 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 原子的最外层电子数相差1.请回答下列问题:
原子的最外层电子数相差1.请回答下列问题: