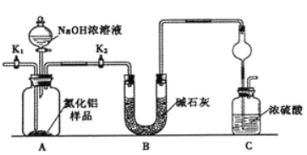
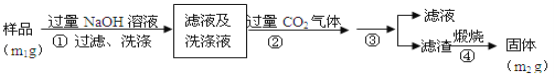
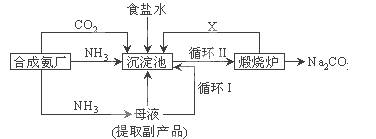
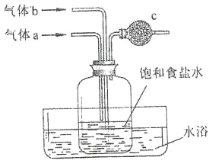
题目内容
【题目】汽车尾气脱硝脱碳主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
N2(g)+2CO2(g) +Q(Q>0)。一定条件下密闭容器
中,用传感器测得该反应在不同时间 NO 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/molL-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-3 | 1.50×10-3 | 1.50×10-3 |
c(CO)/molL-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
完成下列填空:
(1) 写出该反应的平衡常数表达式:_________。 温度升高,二氧化碳气体的浓度将______(填“变大”、“变小”或“不变”)。
(2)前 2s 内的氮气的平均反应速率是:v(N2)=______mol/(Ls);达到平衡时,CO 的转化率为:_____。
(3)工业上常采用“ 低温臭氧氧化脱硫脱硝” 技术来同时吸收 SO2 和氮的氧化物气体(NOx ),以获得(NH4)2SO4 的稀溶液。在此溶液中,水的电离程度是受到了_____(填“促进”、“抑制”或“没有影响”);
若往(NH4)2SO4溶液中再加入少量稀盐酸,则![]() 值将_____(填“变大”、“变小”或“不变”)。
值将_____(填“变大”、“变小”或“不变”)。
(4)如果向 BaCl2 溶液中通入足量 SO2 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象:___________________________。
(5)向另一种可溶性钡盐溶液中通入少量 SO2 气体,会立即看到白色沉淀。该沉淀的化学式为_____; 原可溶性钡盐可能是_____。
【答案】![]() 变小1.75×10-30.89促进变大饱和SO 2溶液中电离产生的SO32 -很少 ,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32 -离子浓度增大,有沉淀产生 。BaSO4Ba(NO3)2
变小1.75×10-30.89促进变大饱和SO 2溶液中电离产生的SO32 -很少 ,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32 -离子浓度增大,有沉淀产生 。BaSO4Ba(NO3)2
【解析】
(1)平衡常数表达式是各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,针对2NO(g)+2CO(g)![]() N2(g)+2CO2(g)反应的平衡常数表达式:
N2(g)+2CO2(g)反应的平衡常数表达式:![]() ;由题给信息可知,该反应为放热反应,温度升高,平衡左移,二氧化碳气体的浓度将变小;正确答案:
;由题给信息可知,该反应为放热反应,温度升高,平衡左移,二氧化碳气体的浓度将变小;正确答案:![]() ; 变小。
; 变小。
(2)前 2s 内c(NO)的变化量为9.50×10-3-2.50×10-3=7.0×10-3molL-1,v(NO)= 7.0×10-3/2=3.5×10-3 mol/(Ls),根据速率之比和系数成正比规律可知,v(N2)=1/2 v(NO)= 1/2×3.5×10-3 mol/(Ls)= 1.75×10-3 mol/(Ls);根据图表信息可知,反应进行到3s后达到平衡状态,c(NO)的变化量为9.00×10-3-1.00×10-3=8.00×10-3 molL-1,CO 的转化率为:8.00×10-3/9.00×10-3=0.89;正确答案:1.75×10-3;0.89 。
(3)(NH4)2SO4属于强酸弱碱盐,NH4+的水解促进了水的电离;溶液中加入稀盐酸后,H+浓度增大,NH4+的水解受到抑制,溶液中的NH4+浓度增大,所以![]() 值变大;正确答案:促进;变大。
值变大;正确答案:促进;变大。
(4)饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀;加入氨水后,溶液中的H+与氨水中的OH-结合,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生;正确答案:饱和SO 2溶液中电离产生的SO32 -很少 ,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32 -离子浓度增大,有沉淀产生 。
(5)BaSO3的溶解度大于BaSO4 溶解度,所以向溶液中通入少量的SO2就立即产生的白色沉淀是BaSO4;硫元素化合价由正4价升变为正6价,化合价升高,说明硫元素被溶液中含有的具有氧化性的离子氧化,所以原可溶性钡盐可能是Ba(NO3)2;正确答案:BaSO4;Ba(NO3)2。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案