��Ŀ����
����Ŀ��һ���¶��£���10 mL 0.40 mol��L��1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�����(������Ϊ��״��)���±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
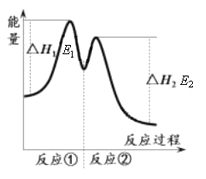
������ʾ����Ӧ���������У��� 2Fe3+��H2O2 == 2Fe2+��O2����2H+���� H2O2��2Fe2+��2H+ == 2H2O��2Fe3+����Ӧ�����������仯����ͼ��ʾ������˵���������
A. Fe3+�������������������ķֽ�����
B. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
C. ��Ӧ2H2O2(aq) == 2H2O(l)��O2(g)����H��E1��E2��0
D. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2)��3.33��10��2 mol��L��1��min��1
���𰸡�C
�������������ܷ�Ӧ![]() ,Fe3+�Ǵ����������������������ķֽ���������A��ȷ����Ӧ����������������ڷ�Ӧ������������ȷ�Ӧ����Ӧ�������������С�ڷ�Ӧ��������Ƿ��ȷ�Ӧ����B��ȷ���ʱ�=�����������������Ӧ�������������Ӧ2H2O2(aq) == 2H2O(l)��O2(g)����H
,Fe3+�Ǵ����������������������ķֽ���������A��ȷ����Ӧ����������������ڷ�Ӧ������������ȷ�Ӧ����Ӧ�������������С�ڷ�Ӧ��������Ƿ��ȷ�Ӧ����B��ȷ���ʱ�=�����������������Ӧ�������������Ӧ2H2O2(aq) == 2H2O(l)��O2(g)����H![]() E1��E2����C������0��6 min�������������ʵ�����0.001mol������H2O2�����ʵ�����
E1��E2����C������0��6 min�������������ʵ�����0.001mol������H2O2�����ʵ�����![]() 0.002mol������v(H2O2)��3.33��10��2 mol��L��1��min��1����D��ȷ��
0.002mol������v(H2O2)��3.33��10��2 mol��L��1��min��1����D��ȷ��