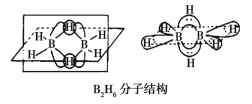
��Ŀ����
����Ŀ���ڻ�ѧ��Ӧ�У���������ѧ��Ӧ�ķ��Ӽ���ײ��֮Ϊ��Ч��ײ����Щ���ӳ�Ϊ����ӡ�ʹ��ͨ���ӱ�ɻ���������ṩ����������л�ܣ��䵥λ��kJmol-1��ʾ��������۲���ͼ��Ȼ��ش����⡣

��1��ͼ�з�Ӧ��______��������������������������Ӧ���÷�Ӧ_______��������Ҫ����������Ҫ�����������ṩ�������÷�Ӧ����H=_________���ú�E1��E2�Ĵ���ʽ��ʾ����
��2����֪�Ȼ�ѧ����ʽ��H2(g)+1/2O2(g) =H2O(g) ��H= ��241.8kJmol-1���÷�Ӧ�Ļ��Ϊ167.2 kJmol-1�������淴Ӧ�Ļ��Ϊ__________��
��3������ͬһ��Ӧ��ͼ������(��)��ʵ��(I)��ȣ����_________����λ����ڻ���ӵİٷ���________����˷�Ӧ����_________����ǰ�����������������������С����������������Ϊ����ܵ�ԭ����_________________��
���𰸡����� ��Ҫ (E2��E1)kJmol-1 409.0kJmol-1 ���� ���� �ӿ� ʹ���˴���
��������
��1��ͼʾ��Ӧ�Ƿ��ȷ�Ӧ����Ӧ��ϼ�Ҫ�������������Ը÷�Ӧ��Ҫ�������ṩ��������Ӧ�ȵ����������뷴Ӧ����������E2��E1���ʴ�Ϊ�����ȣ���Ҫ��E2��E1��
��2����Ӧ�Ļ����ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ�����������ͼ��������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��+��Ӧ���ʱ䣻H2(g)+1/2O2(g) =H2O(g) ��H =��241.8kJmol��1���÷�Ӧ�Ļ��Ϊ167.2kJmol��1�������淴Ӧ�Ļ��=167.2kJ/mol+241.8KJ/mol=409.0kJ/mol��
�ʴ�Ϊ��409.0kJ/mol��
��3��ͼ�������֪�����߱�ʾ���ǽ��ͷ�Ӧ�Ļ�ܣ���λ����ڻ���������෴Ӧ���ʼӿ죬���ﵽƽ��״̬��ͬ����ѧƽ�ⲻ�仯���ı�������Ǽ����˴�����
�ʴ�Ϊ�����ͣ����ӿ죻ʹ�ô�����